- 首页 > 正文
李婕教授解析:MASLD相关肝细胞癌的流行病学、风险因素与精准防控新策略
发表时间:2025-03-19 10:04:49
编者按:代谢相关脂肪性肝病(MASLD),曾称为非酒精性脂肪性肝病(NAFLD),是日益严峻的全球公共卫生问题之一。近年来,MASLD相关肝细胞癌(HCC)在全球范围内的发病率逐年上升,越来越多的证据表明,MASLD在HCC的发生过程中起着重要作用。
2025年2月21~23日于上海召开的“The Lancet Summit: 中国癌症控制”会议中,南京大学医院附属鼓楼医院李婕教授作题为“代谢相关脂肪性肝病相关的肝细胞癌” 的学术报告,全方位解读MASLD及其相关肝硬化、肝细胞癌的流行病学、风险因素、临床特征及治疗策略,《肿瘤瞭望消化时讯》对此次报告主要内容进行整理汇总,以飨读者。

MASLD相关HCC的发展进程经历了从健康肝脏到肝脏脂肪变、代谢相关性脂肪性肝炎(MASH)、肝硬化,最终发展为HCC的多个阶段。最新一项meta分析显示,在全球HCC病例中,有49%与MASLD相关(包括合并其他肝病的情况),其中12%的HCC患者完全由MASLD导致。深入分析发现,与单纯由MASLD引发的HCC相比,同时患有其他肝病的MASLD患者,其肝癌发生率存在显著差异。
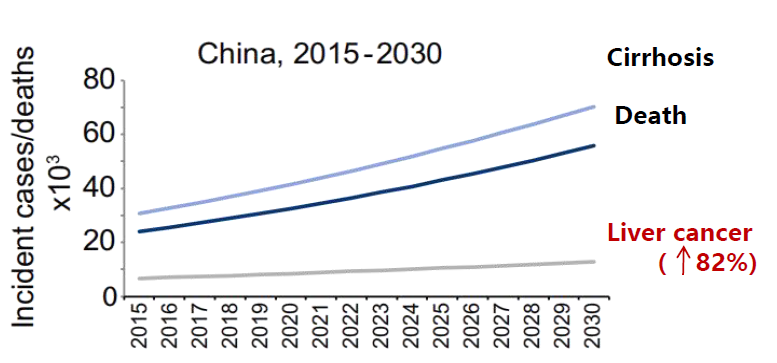
根据一项研究中建立的数学模型预测,2016年至2030年间,由于城市化进程加快,中国将成为全球范围内MASLD增长率最高的国家,也将是肝脏相关疾病死亡人数最多的国家。在中国MASLD患者中,HCC患病人数预计将增加82%(图1)。
另一项来自中国台湾的研究对31 571例MASLD患者进行中位随访为6.32年的观察,其结果显示HCC的10年累积发病率为2.73%,此队列中无肝硬化的MASLD患者发生HCC的比例也相对较低,但在ALT升高的高龄MASLD患者中HCC的风险显著增加。
一项针对1562例HCC患者的调查中,225例(14.4%)患者为MASLD相关HCC,其中37%的患者未伴随肝硬化。与合并肝硬化的MASLD相关HCC患者相比,无肝硬化患者的平均年龄更大、肿瘤体积更大、2型糖尿病的患病率更低、接受肝移植的比例也更低。同时,肝癌的巴塞罗那(BCLC)分期、肿瘤数量、低白蛋白水平及2型糖尿病均被证实与MASLD相关HCC患者预后不良显著相关。
研究表明,代谢综合征、高龄和延误诊断是影响MASLD相关HCC患者的治疗效果及预后的危险因素。由于MASLD相关HCC患者中有一定比例的患者并无肝硬化阶段,经确诊时患者已达HCC阶段,因此,与非其他病因的HCC患者相比,MASLD相关HCC患者接受根治性治疗的机会小,术后并发症发生率高,且肝移植后面临更高的短期风险,但其长期生存率与其他病因HCC患者相似。在药物治疗方面,免疫检查点抑制剂在MASLD相关HCC中的效果可能逊于病毒相关HCC,而酪氨酸激酶抑制剂的疗效则较为接近(表1)。

据统计,全病因HCC患者中仅有15.2%的患者能够接受持续监测,其中MASLD患者的监测比例尤为低下。在合并肝硬化患者的亚组分析中显示70.4%患者能够持续监测,但MASLD病因的患者对于持续监测的接受率仍然最低。基于此,未来亟需多方面的干预措施去提高患者对预后监测的依从性,以帮助我们改善MASLD相关HCC的临床结局。
参考文献:
1.Jie Li. et al. Lancet Gastroenterol Hepatol, 2019; Clin Gastroenterology Hepatology. 2021.
2.Jie Li et al, Global Transitions 5 (2023) 160-169.
3.Estes C, et al. J Hepatol. 2018 Oct;69(4):896-904.
4.Shah PA, Patil R, Harrison SA. Hepatology. 2022 Apr 28.
5.Yip TC et al.J Hepatol. 2022 Mar;76(3):726-734.
6.Shah PA, Patil R, Harrison SA. Hepatology. 2023 Jan 1;77(1):323-338.
7.Crane H, et al. Clin Mol Hepatol. 2024 Apr 16.
8.Jie Li, JunpingShi (Corresponding). Clin Mol Hepatol. 2024.
9.Lee TY et al. Int J Cancer. 2017 Oct 1;141(7):1307-1314.
10.Kanwal F, et al. Hepatology. 2020 Mar;71(3):808-819.
11.Ting Ting Chan, et al.Am J Gastroenterol 2020;115:867-875.
12.Ilkay Ergenc, et al.Hepatology Forum 2021 Vol. 2.
13.Chen VL, et al. Hepatology Communications, 2020,5(1):122-132.
14.Mittal S, et al Clin Gastroenterol Hepatol. 2016 Jan;14(1):124-31.
15.Bengtsson B,et al. Liver Int. 2019 Jun;39(6):1098-1108.
16.Yoon Bin Jung, et al. HPB (Oxford) 2021; 23(7):1113-1122.
17.Jiao Xue, et al.Cancer Management and Research 2022:14 2193–2202.
18.Foerster F et al. J Hepatol. 2022 Feb;76(2):446-457.
19.Karim MA, et al. Clin Gastroenterol Hepatol. 2022 Mar 7:S1542-3565(22)00284-1.
20.Karim MA, et al. Clin Gastroenterol Hepatol. 2023 Mar;21(3):670-680.
21.Huang DQ, et al. Nat Rev Gas Hepat. 2021Apr;18(4):223-238.
2025年2月21~23日于上海召开的“The Lancet Summit: 中国癌症控制”会议中,南京大学医院附属鼓楼医院李婕教授作题为“代谢相关脂肪性肝病相关的肝细胞癌” 的学术报告,全方位解读MASLD及其相关肝硬化、肝细胞癌的流行病学、风险因素、临床特征及治疗策略,《肿瘤瞭望消化时讯》对此次报告主要内容进行整理汇总,以飨读者。

李 婕 教授
南京大学医院附属鼓楼医院
南京大学医学院附属鼓楼医院感染性疾病科主任
主任医师、教授、博士生导师,美国斯坦福大学、香港大学访问学者
国家医学高层次人才(优秀青年医师)
江苏省医学会感染病分会候任主任委员、中国研究型医院学会肝病专业委员会常委
中华医学会感染病学分会委员、中华医学会肝病学分会青年委员
承担5项国家自然科学基金及其他国家、省部级课题共27项,获省部级科研奖励共10项
以第一/通讯作者在Lancet Gastroenterology & Hepatology,Hepatology、American Journal of Gastroenterology、eClinicalMedici、Clinical Gastroenterology Hepatology,Protein&cell等杂志发表SCI论文80余篇,其中3篇入选ESI高被引,入选全球前2%顶尖科学家榜单。
一、MASLD及其相关肝硬化和肝癌疾病负担
01 MASLD流行病学
李婕教授团队的流行病学调查显示,MASLD呈全球流行趋势,总体流行率为29.80%,亚洲地区流行率可达29.63%,且呈逐年上升趋势。02 MASLD相关肝硬化、肝细胞癌流行病学
MASLD是日益增长的肝硬化和肝癌的原因之一。调查显示,1990年到2019年间MASLD相关肝硬化的发病率、流行率和死亡率分别为92.95%,120.12%和76.72%,均呈逐年上升趋势。随着肝硬化发病率的增加,MASLD相关HCC的发病率也随之上升。在1990年至2015年间,HCC的发病率增加了75%,且在不同国家/地区中,MASLD相关HCC占HCC总体负担的1~38%。一项研究显示,MASLD相关HCC已逐渐成为美国地区肝移植候选者的主要病因。MASLD相关HCC的发展进程经历了从健康肝脏到肝脏脂肪变、代谢相关性脂肪性肝炎(MASH)、肝硬化,最终发展为HCC的多个阶段。最新一项meta分析显示,在全球HCC病例中,有49%与MASLD相关(包括合并其他肝病的情况),其中12%的HCC患者完全由MASLD导致。深入分析发现,与单纯由MASLD引发的HCC相比,同时患有其他肝病的MASLD患者,其肝癌发生率存在显著差异。
03 中国MASLD及其相关疾病的负担
一项研究预测,如果未来肥胖和糖尿病的发病率趋于平稳,那么MASLD发生率的增长将保持在0~30%之间。MASH患病率也将增加15%~56%,肝脏疾病死亡率将因人口老龄化而翻倍。根据一项研究中建立的数学模型预测,2016年至2030年间,由于城市化进程加快,中国将成为全球范围内MASLD增长率最高的国家,也将是肝脏相关疾病死亡人数最多的国家。在中国MASLD患者中,HCC患病人数预计将增加82%(图1)。

图1. 中国MASLD相关疾病的负担预测
李婕教授团队的一项回顾性真实世界研究显示,通过收集2018年至2022年间我国8个医疗中心的2831例经病理确诊的HCC患者的临床数据并进行分析发现,其中20.66%的HCC患者合并MASLD,其中的2.93%为单纯MASLD相关HCC患者。此外,在HBV-HCC、ALD-HCC和HCV-HCC患者中,MASLD的比例分别为18.49%、43.40%和29.63%。另一项来自中国台湾的研究对31 571例MASLD患者进行中位随访为6.32年的观察,其结果显示HCC的10年累积发病率为2.73%,此队列中无肝硬化的MASLD患者发生HCC的比例也相对较低,但在ALT升高的高龄MASLD患者中HCC的风险显著增加。
二、MASLD相关HCC的风险因素
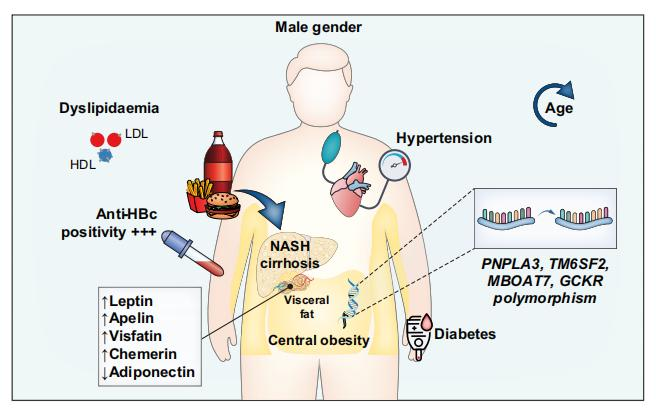
一项回顾性研究显示,在平均9年的随访时间中,271 906例MASLD患者中有22 794例患者发生肝硬化,其中253例最终进展为HCC。研究表明,代谢因素是MASLD相关HCC的重要风险因素。另一项研究表明,在亚洲人群中,高龄、男性以及MASH相关肝硬化是MASLD患者发展为HCC的重要风险因素,这也反映出亚洲HCC的病因正逐渐从病毒性因素转向非病毒性因素(图2)。尽管如此,病毒因素(如HBV感染)仍为MASLD患者晚期纤维化和HCC的风险因素。MASLD患者中,抗HBc阳性患者的肝纤维化和肝硬化发生率显著高于抗HBc阴性患者。与肝纤维化/肝硬化的MASLD患者相比,MASLD合并HCC患者的抗HBc阳性率最高。
图2. 亚洲人群MASLD相关HCC的风险因素
三、MASLD相关HCC的临床特征、治疗与预后
01 临床特征
肝硬化患者更容易发展成MASLD相关HCC,这一现象可能部分归因于非肝硬化患者中女性比例较高、2型糖尿病发生率较低,以及肿瘤多为多发性结节且体积较小,从而使得手术切除率较高等因素。一项针对1562例HCC患者的调查中,225例(14.4%)患者为MASLD相关HCC,其中37%的患者未伴随肝硬化。与合并肝硬化的MASLD相关HCC患者相比,无肝硬化患者的平均年龄更大、肿瘤体积更大、2型糖尿病的患病率更低、接受肝移植的比例也更低。同时,肝癌的巴塞罗那(BCLC)分期、肿瘤数量、低白蛋白水平及2型糖尿病均被证实与MASLD相关HCC患者预后不良显著相关。
02治疗与预后
MASLD相关HCC与HBV相关HCC在临床特征上区别显著。总体来看,MASLD相关HCC患者的年龄偏大,肥胖和代谢综合征的比例较高,且肿瘤体积通常较大。此外,两类HCC患者在肿瘤分化、大血管或微血管浸润方面并无明显差异,但HBV相关HCC患者的总生存率明显高于MASLD相关HCC患者。此外,有研究表明MASLD的存在显著降低了HBV相关HCC患者的无进展生存期,并被视为不良预后的独立危险因素,尤其是对于合并有两种及以上代谢异常的患者,其预后不良的风险更高。因此,在改善HBV相关HCC患者预后之时,对于MASLD的管理也不容忽视。研究表明,代谢综合征、高龄和延误诊断是影响MASLD相关HCC患者的治疗效果及预后的危险因素。由于MASLD相关HCC患者中有一定比例的患者并无肝硬化阶段,经确诊时患者已达HCC阶段,因此,与非其他病因的HCC患者相比,MASLD相关HCC患者接受根治性治疗的机会小,术后并发症发生率高,且肝移植后面临更高的短期风险,但其长期生存率与其他病因HCC患者相似。在药物治疗方面,免疫检查点抑制剂在MASLD相关HCC中的效果可能逊于病毒相关HCC,而酪氨酸激酶抑制剂的疗效则较为接近(表1)。
表1. MASLD相关HCC的治疗效果比较

据统计,全病因HCC患者中仅有15.2%的患者能够接受持续监测,其中MASLD患者的监测比例尤为低下。在合并肝硬化患者的亚组分析中显示70.4%患者能够持续监测,但MASLD病因的患者对于持续监测的接受率仍然最低。基于此,未来亟需多方面的干预措施去提高患者对预后监测的依从性,以帮助我们改善MASLD相关HCC的临床结局。
03 筛查
目前,MASLD患者早期HCC的检出率仅为13.0%,主要原因在于对高危人群识别不足。42.1%的MASLD相关HCC患者并未合并肝硬化,因此也并未将这些患者纳入当前的监测建议范围。有研究提倡,对于未发生肝硬化的患者也应通过使用低成本且高精度的生物标志物进行风险分层,这对早期识别HCC高危患者具有重要意义。因此,对合并各类风险因素的中高危人群进行定期的HCC监测可显著改善患者预后。四、总结
综上所述,随着全球范围内肥胖和2型糖尿病的流行,MASLD在HCC发病中的作用正日益受到重视。MASLD相关HCC患者半数以上为非肝硬化患者,针对此类患者的早期检测和风险分层是疾病管理的一大难题。另外,此类患者通常具有高龄、高肥胖率、高代谢综合征发病率、肿瘤较大且根治性治疗机会较低、手术后并发症发生率较高等特征。上述诸多因素为改善肝癌患者生存质量及预后带来了重大挑战。值得注意的是,当前国际肝癌临床实践指南尚未充分纳入不同病因的诊疗差异。因此,未来研究亟待通过临床试验重点评估MASLD对HCC治疗方案安全性及疗效的影响机制,并据此制定个体化治疗方案,从而提升患者的长期生存质量。参考文献:
1.Jie Li. et al. Lancet Gastroenterol Hepatol, 2019; Clin Gastroenterology Hepatology. 2021.
2.Jie Li et al, Global Transitions 5 (2023) 160-169.
3.Estes C, et al. J Hepatol. 2018 Oct;69(4):896-904.
4.Shah PA, Patil R, Harrison SA. Hepatology. 2022 Apr 28.
5.Yip TC et al.J Hepatol. 2022 Mar;76(3):726-734.
6.Shah PA, Patil R, Harrison SA. Hepatology. 2023 Jan 1;77(1):323-338.
7.Crane H, et al. Clin Mol Hepatol. 2024 Apr 16.
8.Jie Li, JunpingShi (Corresponding). Clin Mol Hepatol. 2024.
9.Lee TY et al. Int J Cancer. 2017 Oct 1;141(7):1307-1314.
10.Kanwal F, et al. Hepatology. 2020 Mar;71(3):808-819.
11.Ting Ting Chan, et al.Am J Gastroenterol 2020;115:867-875.
12.Ilkay Ergenc, et al.Hepatology Forum 2021 Vol. 2.
13.Chen VL, et al. Hepatology Communications, 2020,5(1):122-132.
14.Mittal S, et al Clin Gastroenterol Hepatol. 2016 Jan;14(1):124-31.
15.Bengtsson B,et al. Liver Int. 2019 Jun;39(6):1098-1108.
16.Yoon Bin Jung, et al. HPB (Oxford) 2021; 23(7):1113-1122.
17.Jiao Xue, et al.Cancer Management and Research 2022:14 2193–2202.
18.Foerster F et al. J Hepatol. 2022 Feb;76(2):446-457.
19.Karim MA, et al. Clin Gastroenterol Hepatol. 2022 Mar 7:S1542-3565(22)00284-1.
20.Karim MA, et al. Clin Gastroenterol Hepatol. 2023 Mar;21(3):670-680.
21.Huang DQ, et al. Nat Rev Gas Hepat. 2021Apr;18(4):223-238.
- 推荐文章
加强临床研究合作,提升胃癌诊疗水平——JGCA中日胃癌临床研究专题研讨会精彩撷英
JGCA 2025丨季加孚教授:北大肿瘤医院多项前沿研究成果入选,引领我国胃癌诊疗新征程!
年轻不是“护身符”!新研究揭示结直肠癌三大风险因素,你中招了吗?
复旦大学附属中山医院孙益红教授团队携最新研究成果亮相JGCA 2025,中国胃癌防治水平引全球瞩目
JAMA子刊:HCC罹患风险降低33%!数万例患者研究揭示他汀类药物新作用
JGCA 2025丨卫勃&徐泽宽教授:蛋白质组学分析开启胃癌精准治疗新篇章
郑朝旭教授:无创无痛,让患者活得更有尊严是结直肠癌外科发展的终极目标丨第九届中国医师协会结直肠肿瘤专业委员会年会
于志伟教授:中低位局部进展期直肠癌新辅助放化疗联合免疫治疗模式的临床探索丨中国医师协会结直肠肿瘤专委会年会
国家喊你减肥了!肥胖可引发的5种胃肠道疾病你知道吗?
JGCA 2025现场之声丨李乐平教授:安全且有效!单孔机器人手术为胃癌患者提供新选择
JGCA 2025丨卫勃教授:局部进展期胃癌新辅助治疗未来发展两大方向——“精准和微创”
机器人手术显著改善肥胖胃癌患者临床结局丨周岩冰教授现场解读JGCA(下篇)
低位直肠癌治疗前该不该选择等待观察策略?武爱文教授揭晓答案丨中国医师协会结直肠肿瘤专委会年会
周岩冰教授现场解读JGCA:微创技术和创新理念助推胃癌诊疗迈上新征程(上篇)
心灵驿站丨NEJM:一位肿瘤科医生希望曾经能为那位悲痛的父亲做的事
岂有此“例”丨从三药化疗到钇90放疗:一例乙状结肠癌肝转移患者的MDT全程诊疗启示录
POST-ASCO GI 2025丨黄镜教授:食管癌免疫和靶向治疗捷报频传,精准和分层为未来走向
POST-ASCO GI 2025丨未来可期:从基础研究到临床治疗的典范,覃文新团队深度探索肝癌仑伐替尼耐药靶点及联合治疗新方案
张剑威教授:2025 ASCO GI结直肠癌诊疗新突破——聚焦dMMR免疫治疗、ctDNA动态监测与双免联合疗法
CheckMate-649中国亚组5年数据突破:免疫联合化疗重塑晚期胃癌生存格局,多维度推动胃癌迈向慢病化管理新时代
丁克峰教授:双管齐下,LISH术在结肠癌治疗中根治与功能保留的平衡探索丨中国医师协会结直肠肿瘤专业委员会年会
曲秀娟教授:晚期肠癌精准治疗取得新突破,KRAS G12C抑制剂引领未来方向|中国医师协会结直肠肿瘤专业委员会年会
金晶教授解析局部晚期直肠癌放疗现状与未来:从新辅助治疗到精准医学的跨越丨中国医师协会结直肠肿瘤专委会年会
李太原教授:从“微创”到“无痕”,NOSES手术正重塑结直肠肿瘤外科的诊疗格局丨中国医师协会结直肠肿瘤专委会年会
张卫教授:中国低位直肠癌保肛手术20年:回眸与展望丨中国医师协会结直肠肿瘤专业委员会年会
戴广海教授深度解析MDT在大肠癌综合治疗实践中的价值和探索丨中国医师协会结直肠肿瘤专业委员会年会
POST-ASCO GI 2025丨从跟跑到领跑,邓艳红教授谈中国结直肠癌分子分型突破与转化医学新范式
2025 POST-ASCO GI暨第二届肿瘤基础与转化研究论坛在广州开幕——多学科共话胃肠肿瘤诊疗新未来
李婕教授解析:MASLD相关肝细胞癌的流行病学、风险因素与精准防控新策略
腹膜后肿瘤大会 | 依荷芭丽·迟教授:腹膜后神经内分泌肿瘤的研究进展与治疗策略
刘静教授:结直肠癌靶向治疗进展——精准医学时代的突破丨中国医师协会结直肠肿瘤专业委员会年会
楼征教授:中西医整合创新突破低位直肠癌术后吻合口瘘防治瓶颈丨中国医师协会结直肠肿瘤专业委员会年会
岂有此“例”丨少吃土豆!一项病例对照研究揭晓植物性健康饮食指数与结直肠癌风险之间的关联
王贵玉教授解读CACA结直肠癌指南外科更新要点,推动结直肠癌微创治疗新变革丨中国医师协会结直肠肿瘤专业委员会年会
腹膜后肿瘤大会丨姚兰教授: “预防为主,精准施治”——腹膜后肿瘤切除手术的八字箴言
国际学者盘点ASCO GI突破性研究,早发消化肿瘤日益获关注
腹膜后肿瘤大会 | 北大人民医院张玲玲医生:从联合治疗到精准突破,解析腹膜后肿瘤药物治疗图景
第八届腹膜后肿瘤大会在蓉召开 中国诊疗方案引领国际新方向——多学科协作与科技创新破解罕见肿瘤难题
局部晚期直肠癌治疗:新辅助化疗or新辅助放化疗?这项最新荟萃分析揭晓答案
关注肿瘤患者的生存质量!Q-TWiST研究方法在KEYNOTE-811和KEYNOTE-859试验中的应用丨ASCO GI
ASCO GI聚光录丨彭智教授:CheckMate 649研究5年长生存获益点亮胃癌患者治愈新希望
主席专访丨赵纪春教授:个体化选择和多学科诊疗“两手抓”,共推腹膜后肿瘤深入发展
主席专访丨罗成华教授:辞旧迎新,扬帆启航,开启腹膜后肿瘤研究新时代!
ASCO GI现场丨遗憾!帕姆雷单抗联合化疗在局部晚期胰腺癌中生存获益欠佳
陈燕铭教授团队14项研究成果亮相ADA年会之基础篇 | ADA中国之声
年度盘点丨李恩孝教授:继往开来——2024年胰腺癌领域重磅研究进展
Cell子刊丨突破实体瘤治疗瓶颈!沈琳教授团队揭秘CAR-T细胞疗效差异的"生命密码"
岂有此“例”丨1例BRAF V600E突变结肠癌罕见阴茎转移病例的诊疗过程分享
EASL 2025丨中国智慧闪耀欧洲肝癌峰会,八大摘要抢先看!(临床研究篇)
ASCO GI现场丨双靶治疗在HER2阳性胃癌中未显示生存获益
EASL 2025 丨中国智慧闪耀欧洲肝癌峰会,八大摘要抢先看!(基础研究篇)
国际视角丨阿司匹林可降低林奇综合征患者CRC发生风险,为什么使用率不高?
ASCO GI 2025丨速来围观!HER2阳性胃癌靶向治疗取得新突破
年度盘点丨2024年最受消化时讯读者关注!肝胆胰癌领域TOP10文章
Cell观点:肿瘤“年龄”如何推动结直肠癌筛查策略的变革?
