- 首页 > 正文
于志伟教授:中低位局部进展期直肠癌新辅助放化疗联合免疫治疗模式的临床探索丨中国医师协会结直肠肿瘤专委会年会
发表时间:2025-04-22 16:52:36
编者按:近年来,结直肠癌的发病率与死亡率持续攀升,根据2022年全球癌症统计数据显示,全球结直肠癌的新发病例数位居第三(9.6%),死亡病例数排名第二(9.3%)[1]。在中国,结直肠癌同样呈现高发趋势,庞大的患者群体对治疗方案的优化提出了迫切需求。尤其在中低位局部进展期直肠癌的治疗中,如何提升疗效、改善患者生存质量成为医学界关注的重点。
近日,在第九届中国医师协会结直肠肿瘤专业委员会年会上,哈尔滨医科大学附属肿瘤医院于志伟教授分享了其团队进行的一项探索性临床研究,聚焦“新辅助长程放化疗联合免疫治疗”模式,旨在为患者提供更高效、更安全的治疗方案。本文基于该研究的核心数据与病例分析,梳理治疗策略的创新与突破,为临床实践与未来研究方向提供参考。

于志伟 教授
哈尔滨医科大学附属肿瘤医院哈尔滨医科大学附属肿瘤医院 腹部外科副主任 结直肠外科二病房主任
主任医师 教授 博士研究生导师
研究方向:结直肠癌的外科治疗、发病机制及进展研究。
中国抗癌协会大肠癌专业委员会 委员
中国医药教育学会腹部肿瘤专业委员会 常务委员
国家癌症中心国家肿瘤质控中心结直肠癌质控专家委员会 委员
中国抗癌协会大肠癌专业委员会第二届青年委员会 副主任委员
中国抗癌协会转移专业委员会 委员
中国抗癌学会大肠癌专业委员会遗传学组 委员
中国老年学会老年肿瘤康复委员会 委员
黑龙江省抗癌协会第六届理事会 秘书长
黑龙江省抗癌协会大肠癌专业委员会 副主任委员
黑龙江省抗癌协会转移专业委员会 常务委员
局部进展期直肠癌新辅助治疗困境
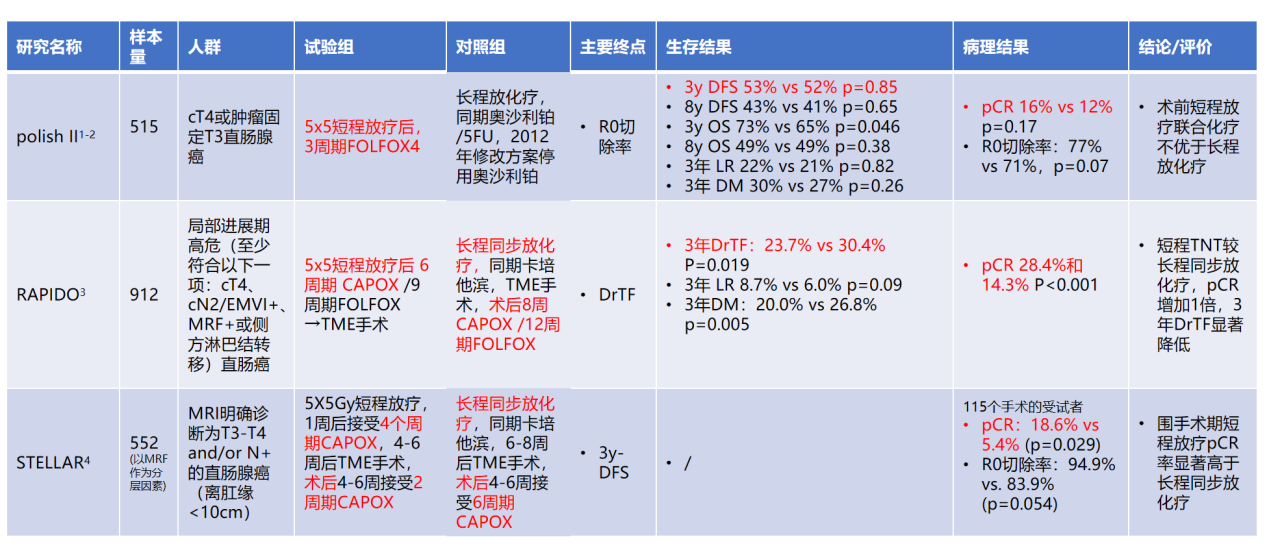
新辅助放化疗+全直肠系膜切除术(TME)是中低位局部进展期直肠癌的标准治疗方案[2]。但局部进展期直肠癌选择术前长程同步放化疗(CRT)还是短程放化疗(SRT)联合手术及术后辅助治疗目前尚有争议。2018年,一项荟萃分析了长程放化疗和短程放疗的利弊,并评估两种模式对直肠癌患者的安全性和有效性。文章按照类型和化疗的具体方式纳入了16项研究,共计2773例直肠癌患者,随机对照试验研究后得出结论,显示相比于短程放疗,长程放化疗具有更好的病理完全缓解(pCR)及肿瘤降期率,但两组在局部复发率、远处转移率、死亡率和3~4级的晚期毒性上并没有明显的差异[3]。
2022年的一项荟萃分析对23项试验在两年内报告的7599例的患者、23项试验在三年内报告的8232例患者和15项试验报告了五年内5856例的患者进行分析评估。对长程放化疗与短程放射治疗的新辅助治疗进行比较发现,与短程放射治疗相比,长程放化疗的五年无瘤存活率提高,两年总存活率提高。得出结论虽然短程放疗被认为比同步长程放化疗更快、更具成本效益,但后者可能会改善长期生存结果。因此,在患者不需急切手术及或不缺乏医疗资源时,可优先行新辅助同步长程放化疗[4]。
此外,多项大型研究(如CAO/ARO/AIO-94、FOWARC)表明,新辅助治疗常用的长程CRT其pCR率约8%~15%,且10年总生存率(OS)未显著优于术后放化疗(表1)。
表1. 长程同步放化疗新辅助直肠癌重要研究
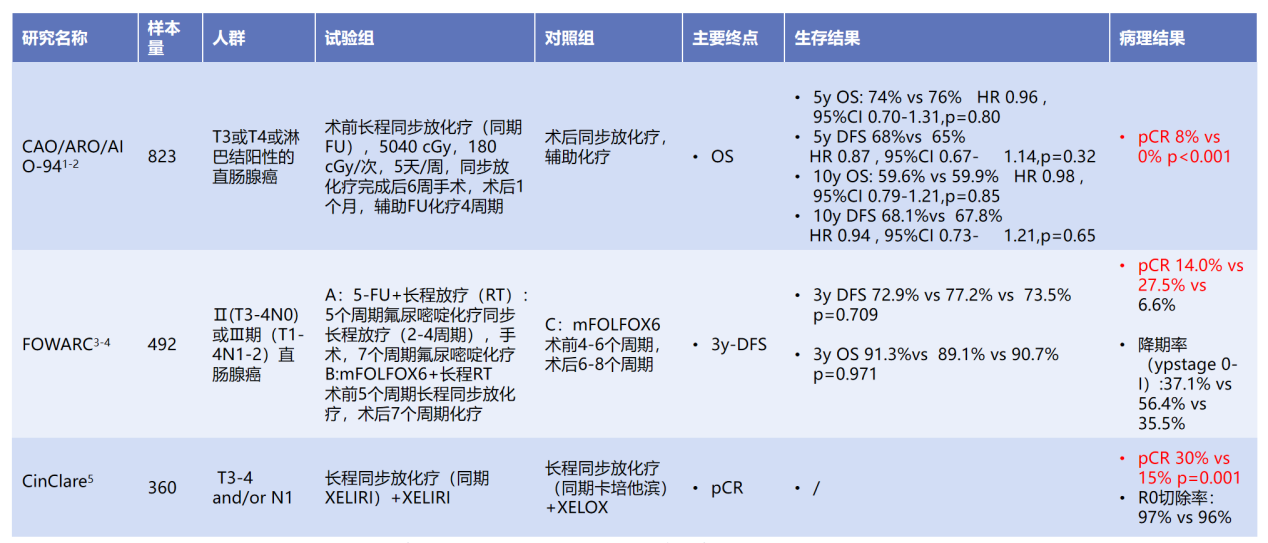
表2. 术前短程放疗序贯化疗 vs 长程放化疗的随机III期研究
免疫治疗加入,改写中低位直肠癌治疗格局
近年来,免疫治疗在结直肠癌治疗中的应用逐渐兴起,为直肠癌的治疗带来了新的希望。特别是放疗与免疫治疗之间的协同作用机制,使得新辅助放化疗联合免疫治疗模式成为研究的热点。临床实践发现放疗具有“远隔效应”,即局部放疗能够缩小原发病灶的同时,能够引起远隔部位转移病灶的缩小,提示放疗可能会激活全身免疫反应,从而导致远隔部位病灶的退缩。基础研究揭示[5],放疗重塑肿瘤微环境,招募免疫细胞浸润到肿瘤细胞周围、诱发肿瘤释放更多肿瘤特异抗原,增加肿瘤细胞的免疫原性,理论上“免疫增强剂”具有放射治疗增敏作用。PD1/PD-L1抑制剂上调肿瘤细胞的MHC和FAS,增加T细胞介导细胞毒效应(图1)。以上为放疗联合免疫治疗奠定了理论基础。
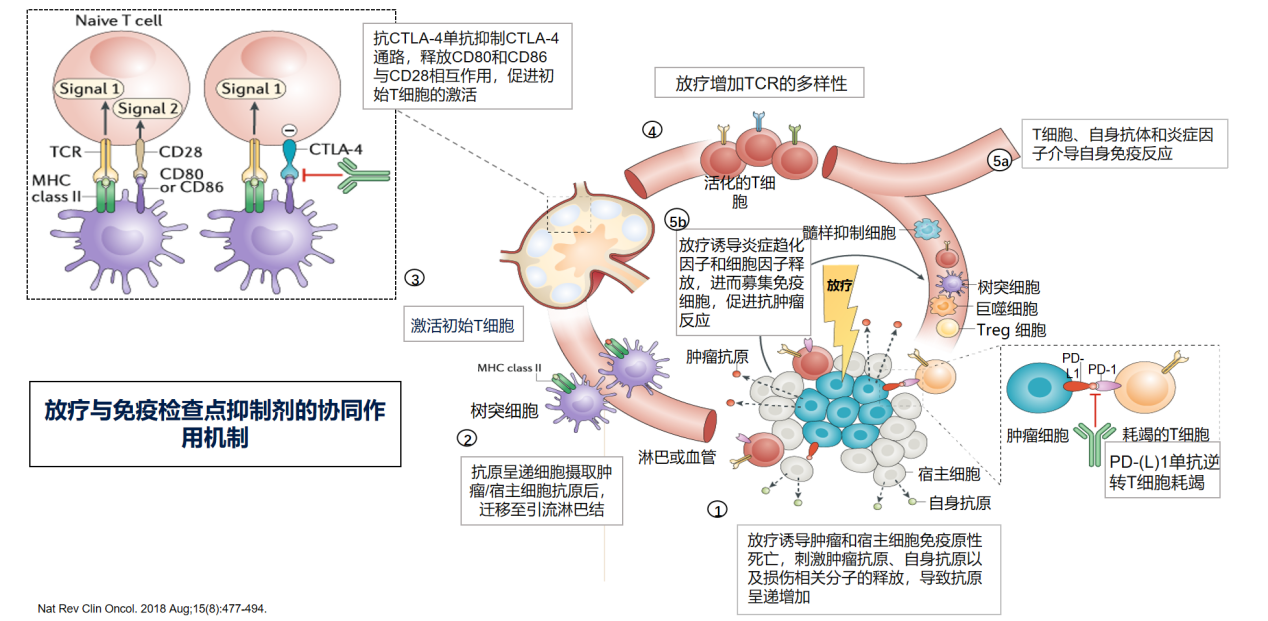
图1. 放疗与免疫检查点抑制剂的协同作用机制
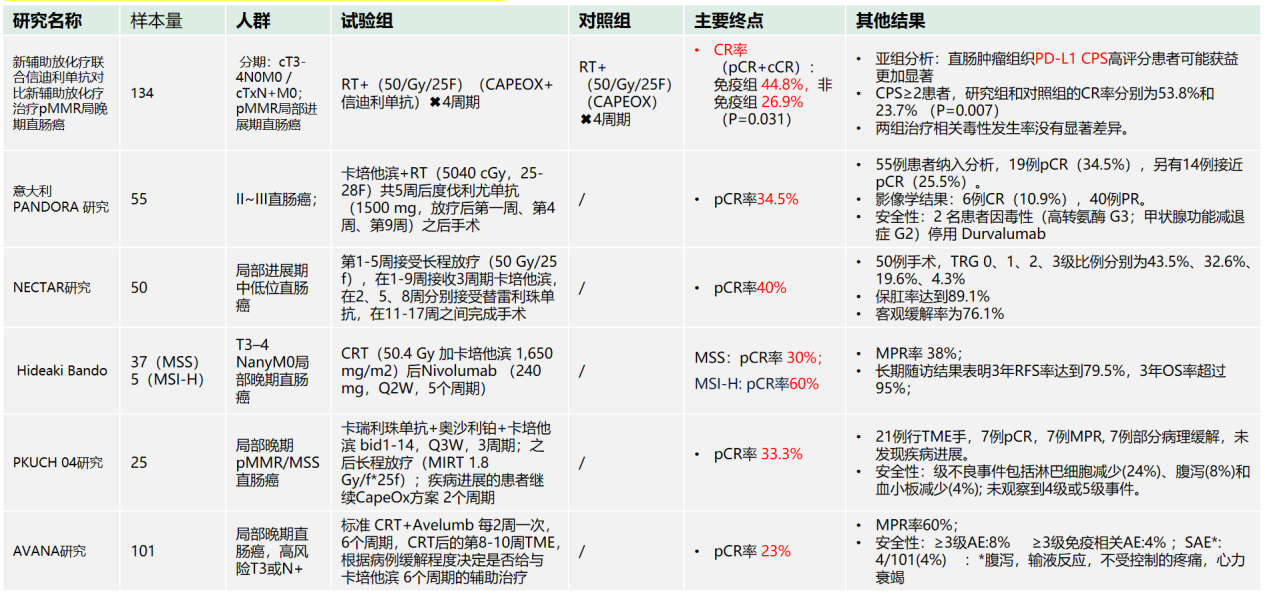
目前,国内已有多项早期研究(如UNION、TORCH)尝试在短程放疗基础上联合免疫治疗,结果显示pCR率有所提升,可达到30%~40%,但长期生存有待随访(表3)。而长程CRT联合免疫的探索(如PANDORA、NECTAR研究)也初显成效,pCR率可达23%~44.8%,且安全性可控(表4)。
表3. 直肠癌新辅助免疫研究-SCRT+免疫(+化疗/靶向)
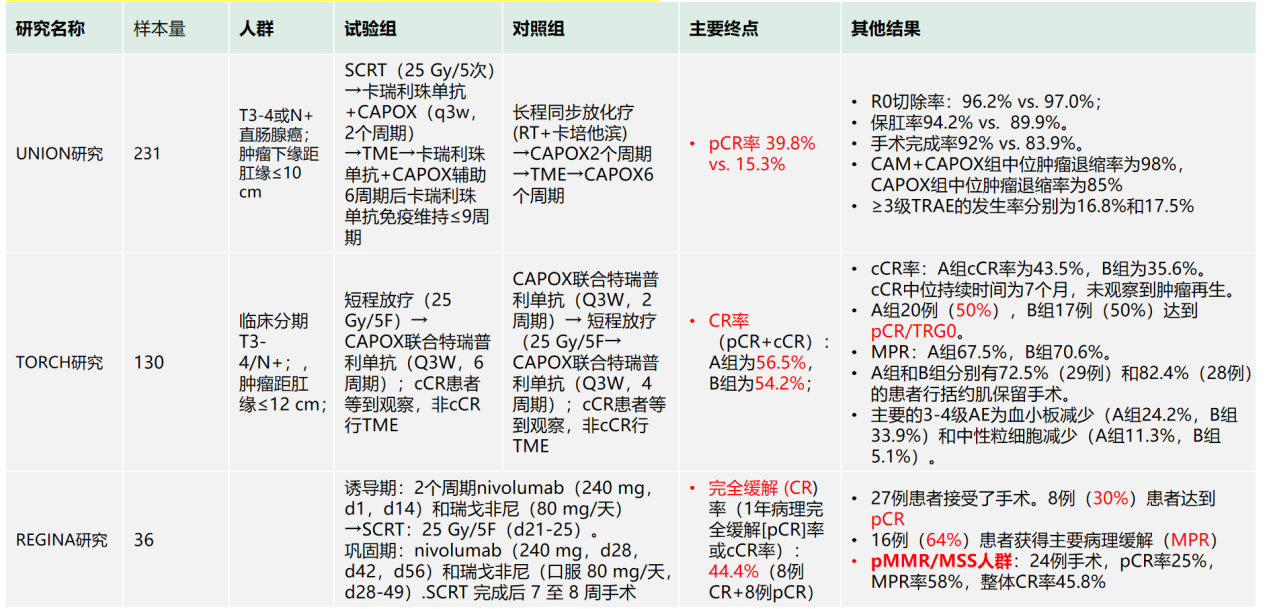
表4. 直肠癌新辅助免疫研究-长程CRT+免疫
截至2025年1月,43例患者完成疗效评估,结果显示,完全缓解率(cCR+pCR)为44.2%,ORR达60.5%,疾病控制率为95.3%。术后pCR率为57.1%,R0切除率100%;低位直肠癌患者中,60%成功保留肛门功能;97.9%患者出现治疗相关不良反应(TRAE),但3级以上事件仅14.9%,无4~5级毒性。
病例实“战”:从理论到实践,
免疫治疗助力直肠癌患者无瘤生存新希望
在上述研究基础上,于志伟教授还分享了该研究组4例结直肠癌患者应用新辅助长程同步放化疗联合卡瑞利珠单抗治疗的真实案例:
病例1
67岁男性,病理诊断为(直肠)粘膜内可见腺癌,T3cN2期,治疗经过如下:
- 2024年1月19日至2024年4月11日,给予患者“卡瑞利珠单抗200 mg/d1,Q3W+奥沙利铂200 mg/d1,Q3W+卡培他滨1500 mg/qd”4个周期,放疗50/45Gy/25次,免疫及化疗期间无不良反应发生。
- 疗效评价:4周期新辅助治疗后,肿瘤从T3cN2降至T3bN1,疗效评价PR(图2)。
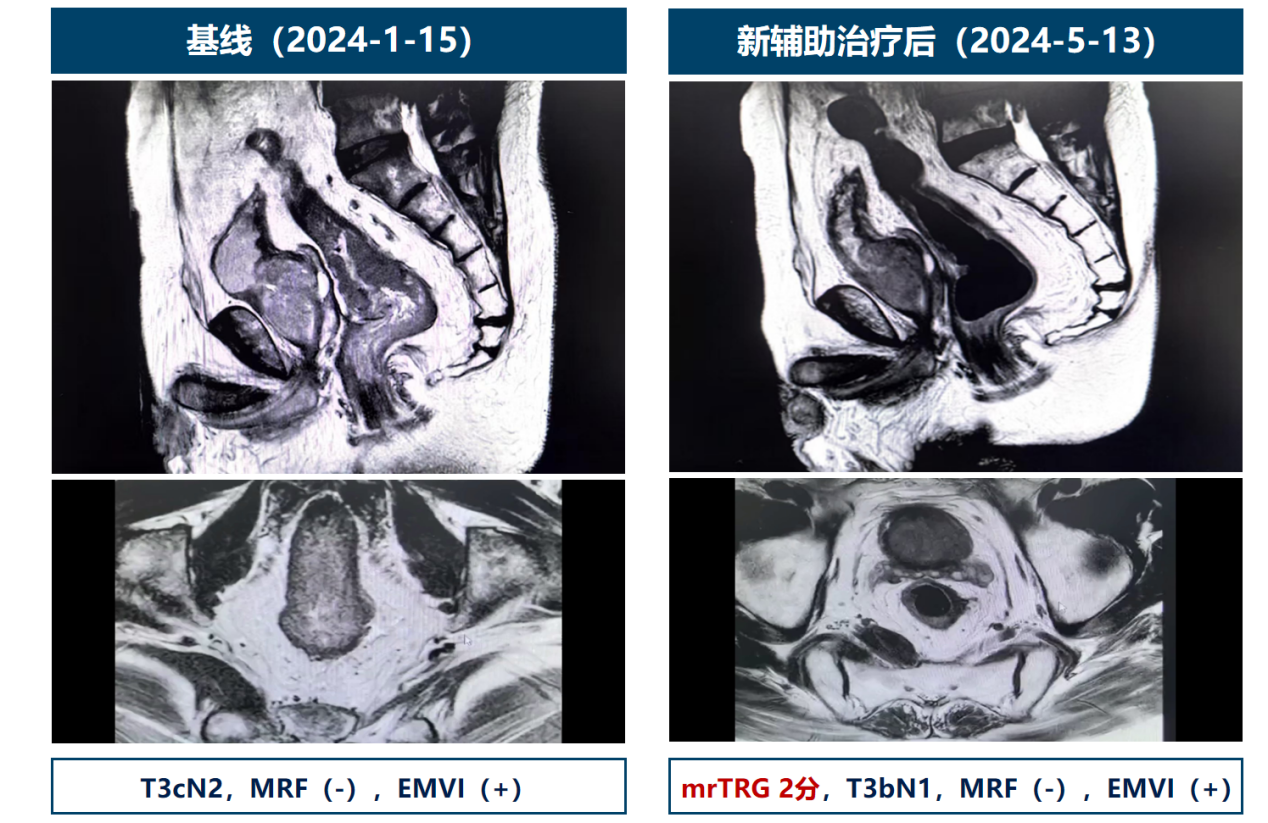
图2. 4周期后疗效评价
- 2024年5月15日(新辅助治疗结束后4周)行“腹腔镜下直肠癌扩大根治术(Dixon+双侧侧方淋巴结清扫术)、回肠造口术”。手术过程顺利,术后恢复良好,无手术相关并发症发生。
- 肉眼所见送检不带肛门直肠切除标本,见溃疡区2×2×0.5 cm。光镜所见部分黏膜缺失,纤维组织增生,大量淋巴细胞浸润。
- 术后病理显示pCR,淋巴结无转移。
病例2
49岁女性,2024年3月8日确诊T3dN2期直肠癌。治疗经过如下:
- 2024年3月13日至2024年5月31日,行“卡瑞利珠单抗200 mg/d1,Q3W+奥沙利铂150 mg/d1, Q3W+卡培他滨1500 mg/qd”4个周期,放疗25次,免疫及化疗期间无不良反应发生。
- 影像学评估为SD(图3),但术后病理证实pCR。
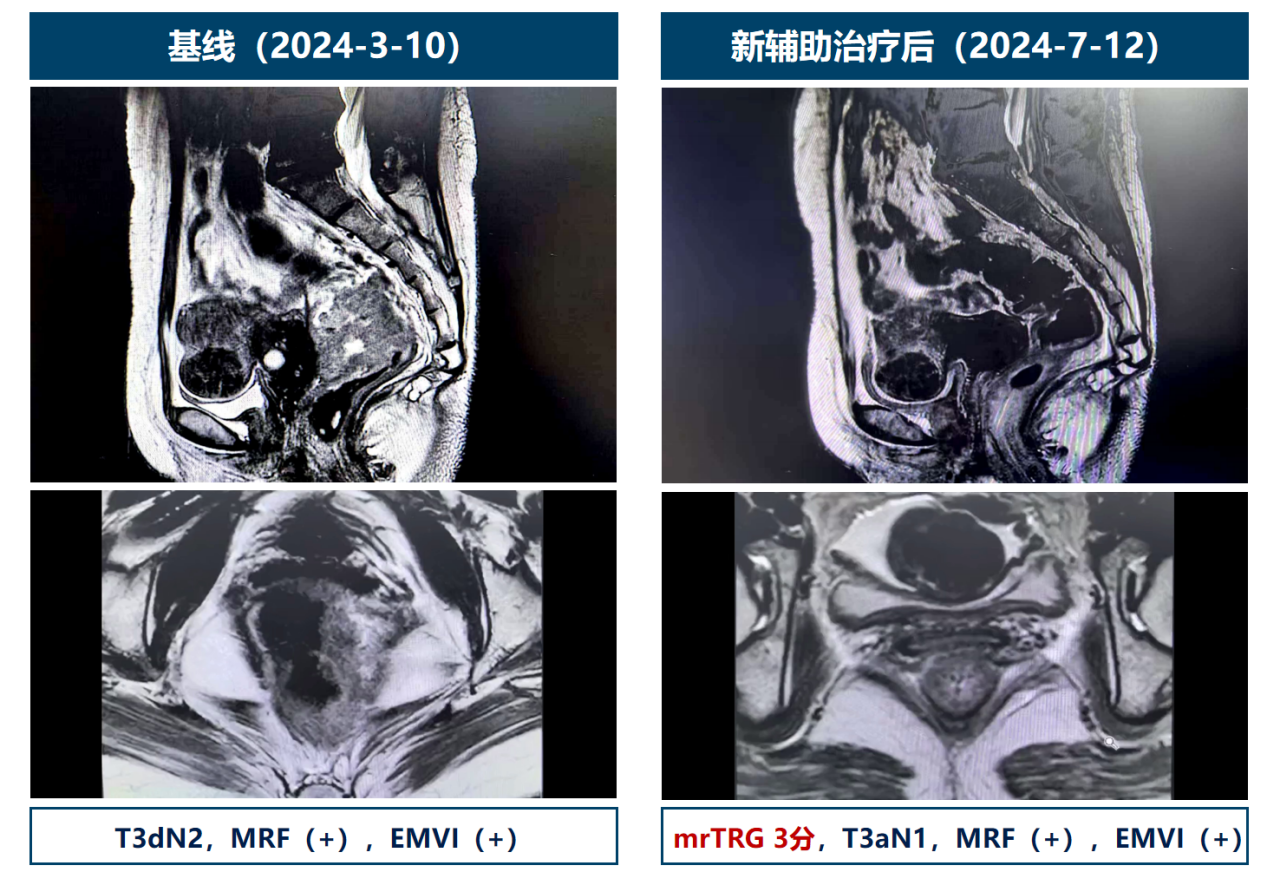
图3. 4周期后疗效评价
病例3为70岁女性,T3bN2M1期直肠癌,经新辅助治疗后远处转移灶消失,原发灶病理显示pCR。病例4为74岁女性,病理诊断为腺癌。直肠MIR提示,下缘距离肛缘3.4 cm,考虑为直肠癌,临床分期为T3aN2。经4个周期新辅助治疗后再次评估分期为T3aN0,疗效评价为PR,术后病理显示病理完全缓解pCR。
上述研究和病例均证实,长程新辅助放化疗联合免疫治疗可显著提高pCR率,且安全性可控,为局部进展期直肠癌患者提供了新选择。然而,以下问题仍需深入探索:(1)优势人群如何筛选?MSI-H、PD-L1高表达、TMB等生物标志物能否预测疗效?(2)如何提高放化疗、免疫治疗之间的协同作用?放疗与免疫的协同方式、化疗强度、药物选择如何协同增效?(3)现有影像学标准(如MRI、PET-CT)能否准确识别病理完全缓解?液态活检(如MRD)或影像组学是否可辅助决策?(4)低位保肛需求局部早期直肠癌免疫新辅助治疗后的疗效的预估尤其重要,目前cCR判定标准能否给予我们足够的信心让患者观察等待?如何做到cCR的精准评估?影像学评估还是MRD?(5)免疫治疗过程的风险评估预判?
综上所述,医学的进步源于对现状的不懈挑战。新辅助放化疗联合免疫治疗的模式,不仅为直肠癌患者带来了更高的治愈希望,更推动了肿瘤治疗从“局部控制”向“系统调控”的范式转变。未来,随着精准医学与免疫微环境研究的深入,更多患者将在这场抗癌战役中赢得生机。
参考文献
[1] Global cancer statistics 2022: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[2] 2020 CSCO 结直肠癌诊疗指南
[3] Compar-ison of Long Course and Short Course Preoperative Radiotherapy in the Treatment of Locally Advanced Rectal Cancer: A Systematic Review and Meta-Analysis. Revista Espanola de Enfermedades Digestivas
[4] A Systematic Review and Network Meta-Analysis of Randomised Controlled Trials Comparing Neoadjuvant Treatment Strategies for Stage II and III Rectal Cancer. Critical Reviews in Oncology/Hematology
[5] Nat Rev Clin Oncol. 2018 Aug;15(8):477-494.
- 推荐文章
