- 首页 > 正文
JGCA 2025丨季加孚教授:北大肿瘤医院多项前沿研究成果入选,引领我国胃癌诊疗新征程!
发表时间:2025-04-25 10:58:21
编者按:日本胃癌学会第97届年会(JGCA 2025)于2025年3月12~14日在日本名古屋会议中心召开,汇聚了来自日本以及全球多个国家的专家学者,共同探讨胃癌防治研究的最新进展以及数字创新技术在胃癌领域的实践和未来发展。北京大学肿瘤医院在本次大会上有多项研究入选大会的口头报告和摘要,涵盖了胃癌的发生、发展、诊断和治疗等方方面面的内容,充分展现了我国学者在胃癌研究领域的突出实力。我们有幸在会议现场采访到JGCA-CGCA专场主席、北京大学肿瘤医院的季加孚教授,深度解析JGCA 2025的主旨和亮点内容。现将内容整理如下,以飨读者!

主席专访
肿瘤瞭望消化时讯:今年JGCA年会主题是“胃癌的数字化创新”,从日本胃癌防治历史、现状、大会议程设置及报告讨论结果看,您如何解读这一大会主题的设置及带来的启示?
季加孚教授:无论是中国还是日本在胃癌防治方面都拥有深厚的历史。从早期的外科手术到现代的综合治疗,特别是在筛查和早期诊断方面,日本的努力为全球提供了宝贵的经验和借鉴。通过这个主题,我们可以看到历史与现代技术的结合,强调了数字工具在改善胃癌预后中的潜力。当前研究显示,胃癌的发病率在全亚洲,特别是中日韩仍然较高,治疗方法需要不断更新。然而,随着数字化技术的应用,如人工智能(AI)和机器人手术,我们能够更准确地进行诊断和个性化治疗。本次会议集中讨论这些技术在临床运用中的具体案例和挑战,为我们胃肠外科提供了宝贵的互动平台。‘胃癌的数字化创新’这一主题不仅是对当前技术进步的回应,也是对未来医疗实践的展望。数字化的创新将推动医疗数据分析、患者管理和远程医疗等领域的进步,使得胃癌的管理更加精准和高效。它还促进了多学科的合作,集结了各方面的智慧,在未来有望实现更大的突破。
肿瘤瞭望消化时讯:中国抗癌协会胃癌专委会(CGCA)与JGCA合作历史渊远流长,今年大会特设JGCA-CGCA专场,主题是“胃癌手术的功能保留”,作为该专场主持嘉宾,请您简要介绍一下该专场的学术亮点,以及JGCA-CGCA未来合作计划。
季加孚教授:本专场聚焦于胃癌手术中功能保留的各种策略,尤其是针对食管胃交界腺癌(AEG)的近端胃切除术。这种手术方法旨在减少术后并发症,特别是反流性食管炎与吻合口狭窄等问题,从而提高患者的生活质量。我们介绍了中国抗癌协会胃癌专委会近期更新的共识,深入探讨有关近端胃重建的最佳实践和建议,包括各种抗反流重建方法,如双道重建、胃管重建和皮瓣吻合,这些方法都得到了中国胃肠专家的广泛支持。我们还分享北京大学肿瘤医院在近端胃切除术中应用功能保留技术的经验,包括我们对Kamikawa吻合技术的改进。这一新颖的重建方法(食管胃“拱桥”重建)显著缩短了手术时间,且直到目前为止未出现术后漏口,短期结果令人满意。此外,通过对多项研究的回顾,我们讨论功能保留技术在人群中产生积极的影响,提高患者的术后恢复效果,减少并发症的发生。
在未来,我们希望共同开展多中心研究项目,深入探讨功能保留手术在不同患者群体中的应用效果及长期预后,以推动这一领域的实践发展。进一步加强在胃癌防治领域的教育和宣传工作,提高公众和临床医生对功能保留手术益处的认知,促进这一领域的知识传播。我们期待JGCA与CGCA的合作能在全球范围内推动胃癌治疗的发展,为患者带来更好的预后和生活质量。

北京大学肿瘤医院优秀研究成果展
一、铂类药物诱发ecDNA促进胃癌恶性进展的机制研究
第一作者:朱焕博(北京大学肿瘤医院,胃肠肿瘤中心/胃肠肿瘤转化研究室)
染色体外DNA(ecDNA)是独立于染色体的环状DNA,常见于肿瘤发生和进展过程中。自1965年首次发现ecDNA以来,对于这一现象的研究逐渐增加。近期研究表明,至少14%的肿瘤含有ecDNA,而在胃癌中这一比例上升至53%。ecDNA的独特结构使得可以检测到含有它的肿瘤的癌基因急剧扩增。与不含ecDNA的肿瘤相比,携带ecDNA的肿瘤具有更强的肿瘤生长、迁移、侵袭、异质性和耐药能力,患者的预后生存较差。因此,理解ecDNA在肿瘤中的机制可能有助于改善携带ecDNA患者的预后。首先,我们分析了本中心临床队列,发现化疗后ecDNA的数量增加。对化疗反应不佳的患者,其ecDNA含量更多。此外,转移性肿瘤更有可能携带ecDNA,这表明化疗可能诱导ecDNA的生成并增强肿瘤转移。为了深入研究这一点,我们建立了顺铂(CDDP)耐药细胞系,发现MGC-803 CDDP耐药细胞系含有ecDNA,并且自噬和细胞迁移水平较高。经过两个月的CDDP治疗后,我们发现SGC-7901野生型细胞系的线性DNA转变为环状DNA,证实了CDDP治疗诱发了ecDNA的形成。随后,我们尝试在CDDP耐药细胞系中添加羟基脲、NU7026或敲低ecDNA携带的基因以增强ecDNA消除,发现ecDNA的规模和数量、以及自噬和细胞迁移水平均受到抑制,这表明ecDNA可以增强自噬和细胞迁移,而这一过程可以通过消除ecDNA或敲低特定基因来逆转(图1)。此外,我们还发现HU和CDDP之间存在协同作用。总之,我们发现ecDNA的生成可能是化疗后药物耐药的一个原因,干扰ecDNA可以逆转ecDNA增强的自噬和细胞迁移水平,这可能成为治疗携带ecDNA患者的一种潜在方法。
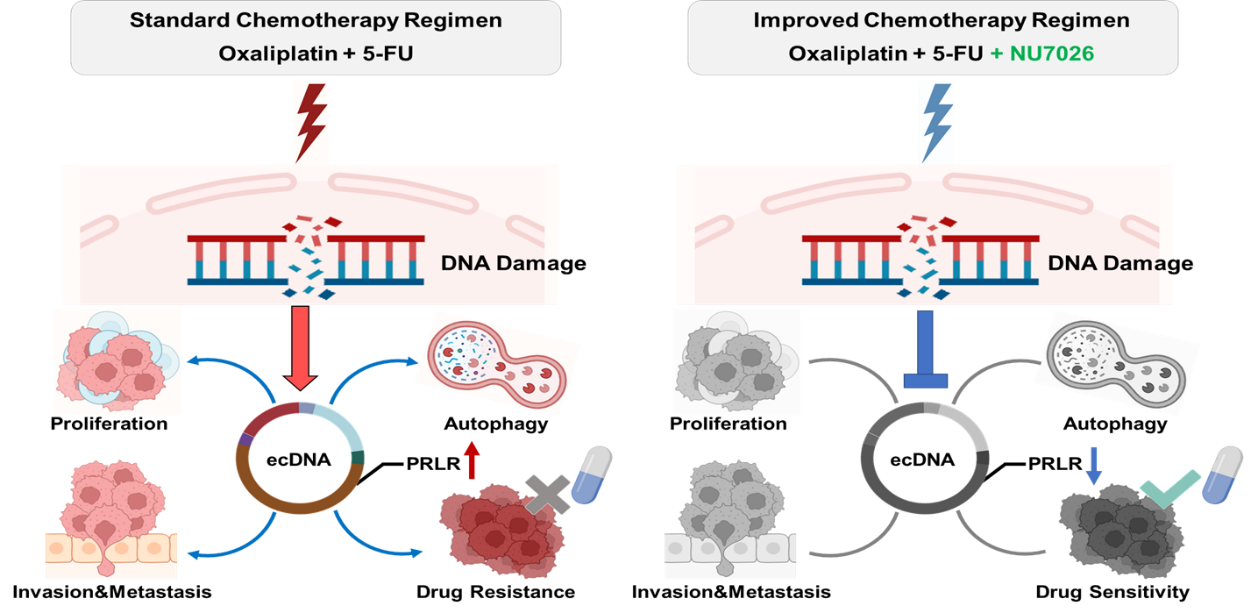
图1. 铂类药物诱发ecDNA促进胃癌转移
二、胃癌进展中肿瘤微环境的时空异质性与分子调控机制
第一作者:陆振华(北京大学肿瘤医院,胃肠肿瘤中心/胃肠肿瘤转化研究室)
早期胃癌的预后相对良好,因此研究正常组织到癌前病变,最终到晚期胃癌的胃癌进展机制至关重要。在本研究中,我们应用了10x HD空间转录组技术,系统分析了癌前病变、早期胃癌到晚期胃癌进展过程中肿瘤微环境的时空异质性和分子调控机制。基于HE染色,我们定义了胃癌发展的不同阶段。正常阶段与化生阶段之间的差异基因富集分析显示,甘油三酯代谢、细胞-细胞连接组织和消化吸收等通路上调,而神经系统和抗微生物肽等通路下调。在从化生到上皮内肿瘤的过渡阶段,GPCR配体结合、神经系统、基质金属蛋白酶的激活以及WNT配体生物合成和运输等通路上调。在从上皮内肿瘤进展到癌症的过程中,α-防御素、相位0-快速去极化以及核苷和游离嘌呤和嘧啶碱基跨膜运输等通路上调。通过分析正常-化生-上皮内肿瘤-癌症阶段交叉的基因,我们确定了三个在所有阶段一致上调的基因:GALR2、PAX2和DDX43。通过TCGA数据库验证显示,GALR2在肿瘤中的表达显著提高,并与预后相关。




三、一种靶向CLDN18.2的纳米平台通过时空调控磁热疗实现胃癌的协同免疫治疗
第一作者:王雪莹(北京大学肿瘤医院,胃肠肿瘤中心/胃肠肿瘤转化研究室)
胃癌的精准治疗需要创新治疗靶点和技术。CLDN18.2是一种新型的胃特异性生物标志物,在临床病理特征和肿瘤免疫微环境中发挥着重要作用。我们在536例胃癌患者的队列中识别出高水平的CLDN18.2表达,并发现其与免疫相关因子之间存在负相关,这暗示着针对CLDN18.2的工程化治疗在协同免疫疗法中具有前景(图2)。我们使用了一种多模态纳米复合材料,该材料由结合CLDN18.2单克隆抗体1D5和荧光染料ICG的超顺磁性纳米颗粒组成,应用于通过结合磁粒子成像和磁热疗的治疗诊断平台进行胃癌成像和治疗。这些纳米颗粒能够实现精确的热定位,优化给药时间窗口和交替磁场操作。该策略能够招募树突状细胞,并通过强大的免疫原性补偿CD8+T细胞中的PD-1耗竭状态。免疫检查点抑制剂的应用增强了抗肿瘤反应。我们基于这一时空调控策略,进行了从细胞系到细胞衍生异体移植和患者衍生异种移植的集成前临床和转化试验,为CLDN18.2阳性个体提供了一种新的治疗选择,并提高了对免疫疗法的反应性。
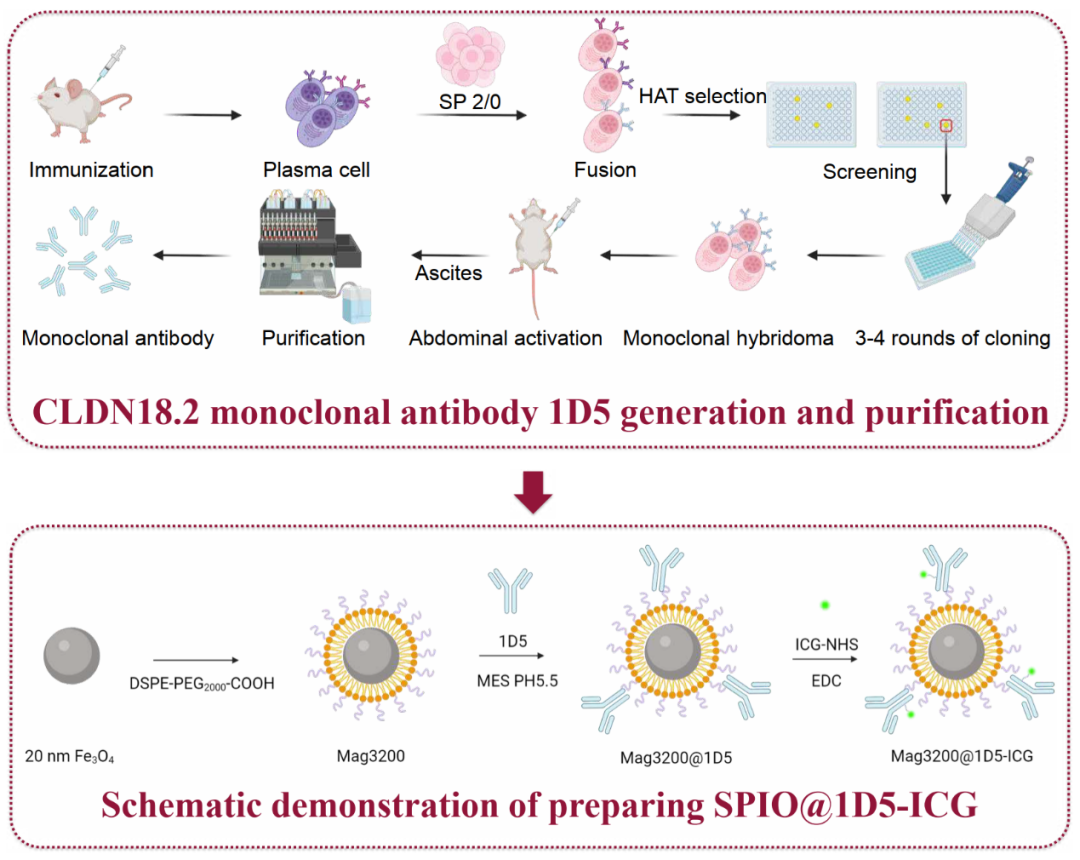
图2. CLDN18.2的工程化治疗在协同免疫疗法中具有前景
四、解析胃癌三级淋巴结构的空间特征
第一作者:谢意(北京大学肿瘤医院,消化内科)
三级淋巴结构(TLS)已被证明与胃癌(GC)的肿瘤预后相关。然而,TLS内免疫微环境在多维度上的特征仍未被充分探索。我们的研究发现,肿瘤核心(TC)中TLS的存在与改善的免疫相关总生存期(OS)显著相关。多重免疫组织化学分析显示,与肿瘤和基质区域相比,肿瘤核心内TLS中的CD8+LAG-3-PD-1+TIM-3-、CD4+PD-L1+和CD4+FoxP3-T细胞密度显著更高。值得注意的是,CD8+LAG-3-PD-1+TIM-3-T细胞与改善的OS显著相关(P=0.0232)(图3)。在侵袭边缘的TLS中,富含非耗竭性CD8+T细胞,如CD8+LAG-3-TIM-3-、CD8+PD-1-和CD8+LAG-3-PD-1-TIM-3-T细胞。相比之下,正常区域中的TLS包含更多耗竭性CD8+T细胞,包括CD8+PD-1+和CD8+LAG-3+PD-1+TIM-3+T细胞。不同位置肿瘤浸润免疫细胞(TIICs)的差异水平突显了TLS中TIICs在GC中的异质性分布。在TLS内部,免疫细胞在空间上更接近,并表现出更强的细胞间相互作用,单细胞RNA测序进一步证实了这一点。我们的研究全面分析了不同区域TLS的特征,表明TLS内频繁的细胞间通信塑造了一个活跃的免疫微环境,从而强调了其预后价值。
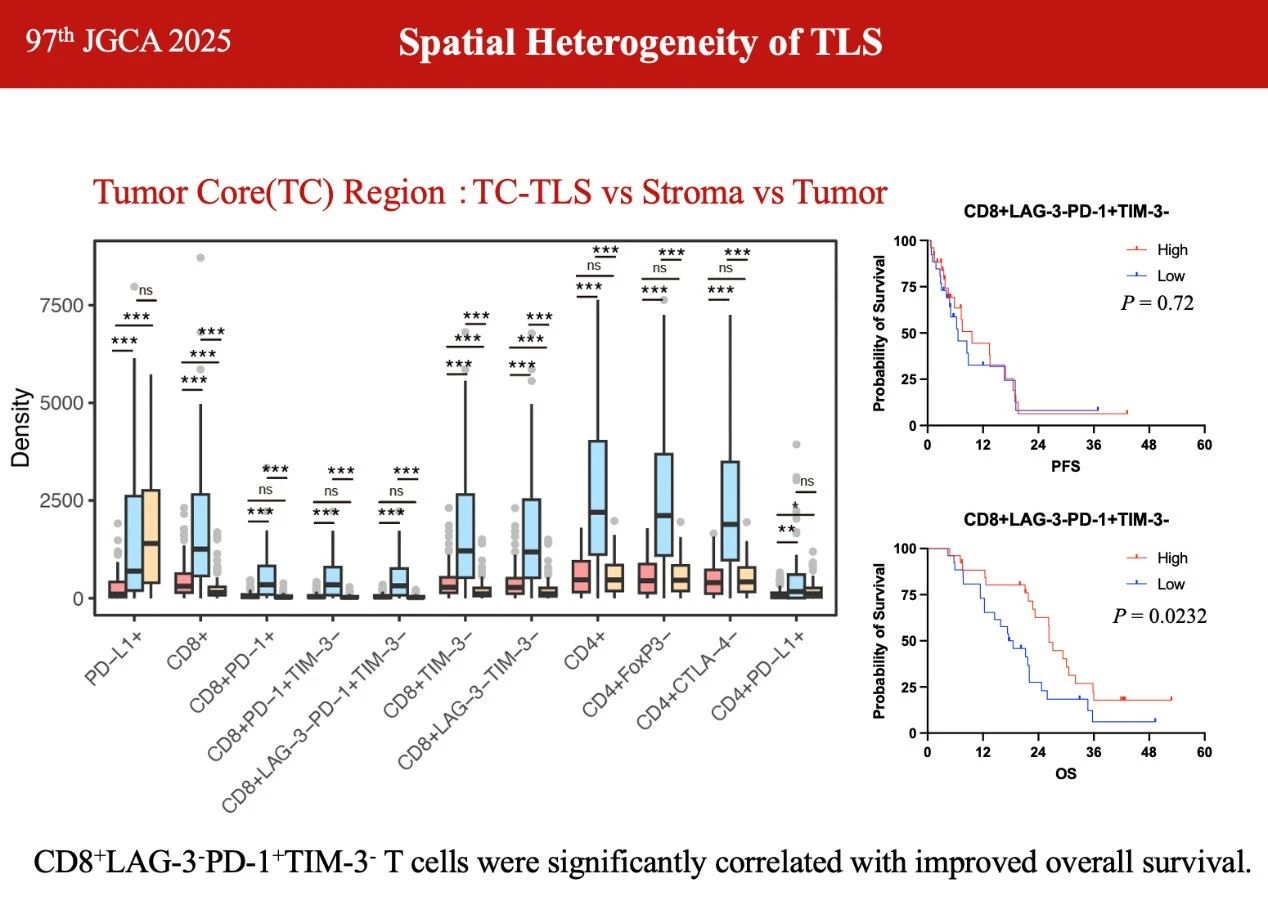
图3. CD8+LAG-3-PD-1+TIM-3-T细胞与改善的OS显著相关
五、肿瘤免疫治疗过程中微环境的单细胞动态图谱
第一作者:高翔宇(北京大学肿瘤医院,胃肠肿瘤中心)
免疫检查点抑制剂旨在增强抗肿瘤适应性免疫,但仅有少数患者能够获得持久的治疗反应。不同患者之间的耐药性使得这一问题亟待阐明。基于来自13种癌症类型的30项免疫治疗研究的单细胞转录组公共数据集,我们构建了一个包含超过242万个免疫和非免疫细胞的综合数据库。通过免疫细胞簇的协方差,我们将肿瘤微环境分为4种不同的亚型,并评估了每个患者样本的细胞组织结构。对细胞组成和相互作用组的分析揭示了所有肿瘤微环境亚型中同时存在的免疫激活和抑制因子。为了深入探究治疗过程中细胞特征的动态变化,我们进行了伪时间分析,并提供了患者水平上疾病进展轨迹的图谱。LYVE1+巨噬细胞与多种癌症类型中的无反应患者相关。此外,我们鉴定了FCGRT,这是一种在LYVE1+巨噬细胞中高表达的Fcγ受体,它在不同的进展路径中富集,并与较差的免疫检查点抑制剂(ICI)反应相关。靶向FCGRT可能在现有的ICI治疗中带来潜在的协同效应,并在特定肿瘤微环境背景下实现精准干预。
六、胃癌术后并发症临床预测模型的开发及单中心队列验证
第一作者:吴舟桥(北京大学肿瘤医院,胃肠肿瘤中心)
胃癌术后并发症(POCs)的发生率仍然较高,影响了中国18.1%的患者,并造成了显著的疾病负担。然而,目前缺乏一种简单且严谨的模型用于胃癌患者的风险评估。我们利用胃肠外科手术后腹部并发症发生率(PACAGE)数据库中的患者信息,通过逻辑回归构建了一个包含五个变量的预测模型——胃癌PACAGE(G-PACAGE)系统。该模型的预测效果在单中心队列中进行了验证,并将其性能与生理和手术严重程度评分(POSSUM)进行了比较。结果表明,G-PACAGE模型在建模队列和验证队列中均表现出良好的风险分层能力(P<0.001和P=0.006)。此外,POSSUM评分在验证队列中对POCs的高风险和低风险患者也表现出有效的分层能力(P=0.003)。然而,E-POSSUM评分的表现较差。我们使用五个临床变量建立了一个简化的胃癌术后并发症评分模型——G-PACAGE系统,其预测性能与POSSUM评分相当。同时,与POSSUM评分相比,G-PACAGE系统更加简洁。
小结
在本届日本胃癌协会年会上,北京大学肿瘤医院展示了在胃肠肿瘤领域的最新研究成果,涵盖了从铂类药物诱发ecDNA机制、肿瘤微环境时空异质性、靶向CLDN18.2的纳米平台治疗、三级淋巴结构特征、免疫治疗单细胞动态图谱到术后并发症预测模型等多个前沿方向。这些研究不仅深化了对胃癌发生、进展及治疗机制的理解,还为临床诊疗提供了新的策略和工具,获得了与会各方的高度评价,进一步推动了北京大学肿瘤医院在胃肠肿瘤领域的国际影响力。

- 推荐文章
