编者按:在肿瘤治疗中,一旦出现肿瘤增大或新的病灶,基本上就意味着疾病出现进展,该阶段的治疗手段及药物基本被判“死刑”,只能寻求新的治疗方法。然而,在使用免疫治疗时,情况则有所不同。当出现上述情况,不排除是假性进展的现象。假性进展,即在治疗初期出现原有病灶增大或新病灶的暂时现象,随后这些病灶又逐渐缩小。
近年来,随着免疫治疗在结直肠癌治疗领域的重要性日益凸显,如何准确判断假性进展与真实进展成为了治疗过程中的关键一环。本期《岂有此“例”》特别关注了一例转移性结直肠癌(CRC)患者在接受免疫检查点抑制剂(ICI)治疗后出现非典型、有症状的假性进展的病例。该病例报告已发表于权威医学杂志《英国医学杂志》(BMJ,IF:105.7),现将内容整理如下,以飨读者。

病例再现
治疗过程
- 患者,男性,70岁有余,因盲肠腺癌在外部医院接受全腹结肠切除术和末端回肠造口术后,前来笔者医院接受首次肿瘤科就诊。
- 术后影像学检查显示,在髂嵴上方的右侧后腰皮下部位存在一个4.2×2.1 cm的残留病灶(图1A)。患者接受了介入放射学引导的左侧后腰可触及肿块的活检,结果证实为具有黏液性特征的中度分化腺癌。由于组织样本不可用,因此未进行MMR蛋白免疫组织化学检查。在等待二代测序(NGS)结果的同时,决定继续给予患者全身治疗。
- 初始化疗治疗方案:4个周期的5-氟尿嘧啶和奥沙利铂治疗。不幸的是,重新分期扫描显示,右下腹的一个多房囊性肿块明显增大,该肿块侵犯小肠的一部分和右侧髂腰肌,并穿过后腹膜筋膜伸入皮下组织,大小约为5.2×10.4×9.9 cm(图1B)。此外,还发现了一个可能与右侧腰大肌相邻的、大小约为2.8×2.1 cm的独立的第二病灶。使用NGS对肿瘤组织进行突变检测发现,存在PMS2突变(剪接区变异,c.989–2A>G)、KRAS突变和高肿瘤突变负荷(46.8突变/MB,第99百分位),PD-L1肿瘤比例得分为95%。胚系突变测试证实了PMS2的改变,与林奇综合征的诊断一致。
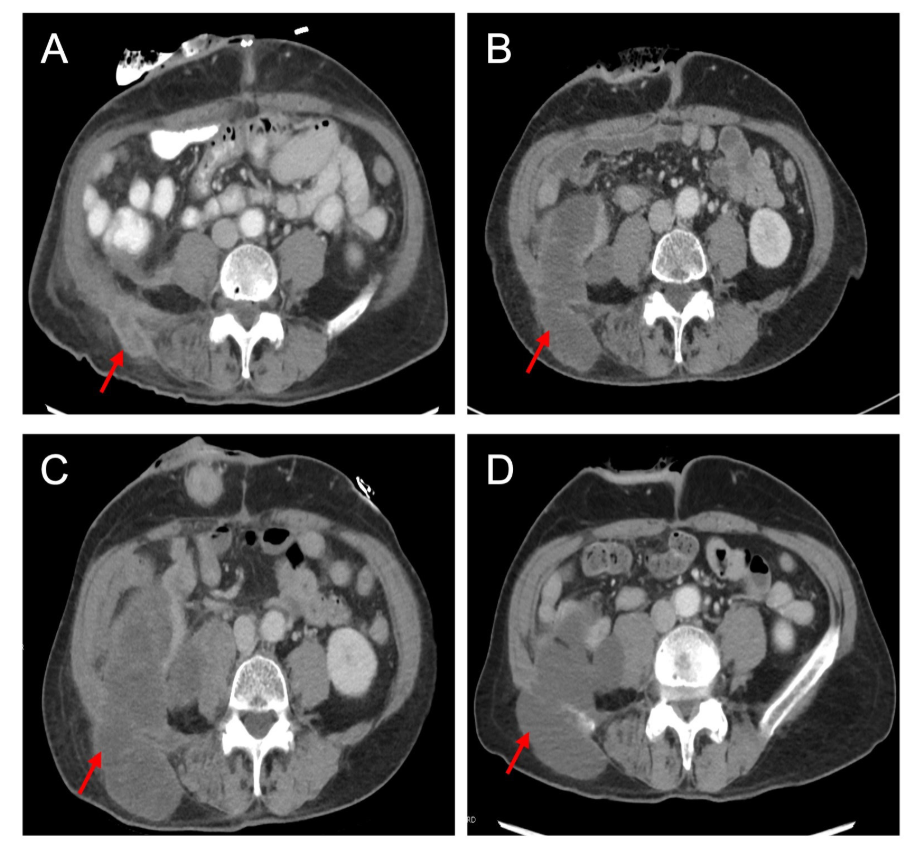
图1. 轴位CT扫描显示右下腹肿块。(A) 全腹结肠切除术后的初始残留病灶;(B) 四个周期的5-氟尿嘧啶和奥沙利铂治疗后右下腹肿块的进展;(C) 两个周期的帕博利珠单抗治疗后显示多房复杂囊性肿块的增大;(D) 六个周期的帕博利珠单抗治疗后多房复杂囊性肿块大小的减小。
面对这种明显的肿瘤进展,有三种临床治疗方案选可选:(1) 继续应用帕博利珠单抗治疗;(2) 改用另一种治疗形式;(3) 将患者转诊到临终关怀机构并提供症状管理的姑息治疗。
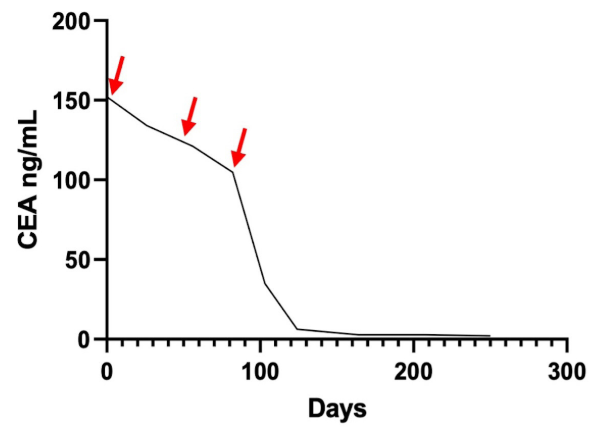
图2. 癌胚抗原(CEA)随治疗时间的变化图。第一个箭头(左)表示手术完成后、开始使用5-氟尿嘧啶和奥沙利铂(FOLFOX)之前的CEA水平,第二个箭头(中)表示完成四个周期的FOLFOX后、影像学证据表明疾病进展时的CEA水平,第三个箭头(右)表示使用两个周期的帕博利珠单抗后、因影像学检查结果表明疾病进展而入院时的CEA水平。
结果和随访
患者仍可继续从免疫治疗方案中获益,并恢复了基线活动水平,可独立完成所有日常活动。在最后一次随访中,患者仍表现为无症状,没有感到任何疼痛或不适。最近一次腹部和骨盆的CT扫描(图3)显示,在完成16个周期的帕博利珠单抗系统治疗后,右侧结肠旁沟内连接右侧腰大肌(大小为3.2×3.0 cm)、小肠和髂腰肌(大小为5.3×3.2 cm)以及髂腰肌(大小为3×2.2 cm)的复杂不规则肿块仍存在,该肿块通过后内侧腹壁延伸到右侧腰部的皮下脂肪(大小为6.8×3.2 cm)。
在评估帕博利珠单抗治疗MSI-H晚期结直肠癌患者的KEYNOTE-177试验的亚组分析中,与野生型相比,具有KRAS/NRAS突变的患者情况更糟。因此,笔者选择继续每6周进行一次帕博利珠单抗的系统治疗,并进行常规随访和每3~6个月的影像学检查。虽然KRAS/NRAS突变与帕博利珠单抗耐药之间存在相关性,但更广泛的RAS突变谱的动力学可能有所不同,并可能为该患者带来积极的结果。
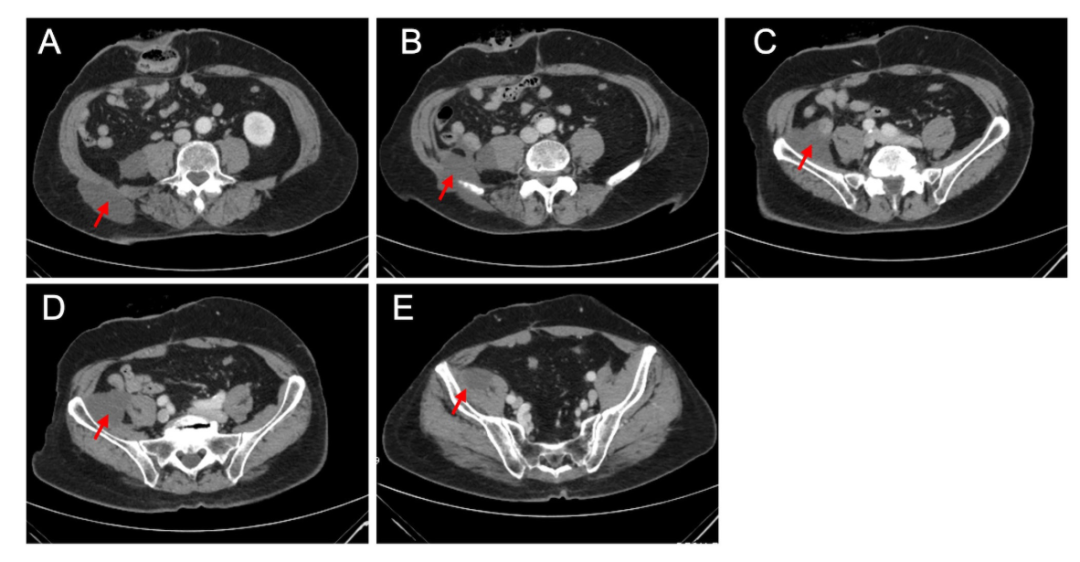
图3. 轴位CT扫描显示经过16个周期的帕博利珠单抗治疗和最近一次随访后,右下腹肿块有所改善
讨论
通过影像学检测到的疾病进展或治疗失败,常常会为临床医生提前调整癌症特异性治疗方案提供信号,但这可能会导致假性进展患者的预后恶化。有些癌症患者虽然免疫治疗初期看似无改善,但随后却能从ICI治疗中逐渐获益。在本病例中,若我们在患者看似出现进展时,就将其转入临终关怀并仅提供姑息治疗,患者将错过关键的第2周期帕博利珠单抗治疗,增加其真正疾病进展的风险。
目前,因缺乏快速鉴别真正进展与假性进展的工具,导致部分患者治疗中断,这对患者极为不利。因此,该领域急需开发新技术和方法,以准确区分疾病进展的真实情况,避免不必要的治疗变更,延长有效治疗时间,减少不必要的姑息治疗转换,从而保障患者得到最佳治疗效果和生活质量。
当前,假性进展的诊断主要依赖于临床医生的经验判断,这通常通过观察肿瘤增大来评估。这种诊断的可靠性依赖于后续扫描显示的ICI治疗后肿瘤改善情况的回顾性验证,这限制了临床医生对ICI治疗有效性的即时和准确评估,使患者处于潜在的风险之中。因为部分患者可能因真正的疾病进展而需要调整治疗方案,而另一些出现假性进展的患者则可能因继续免疫治疗而获益。
在诊断肿瘤进展方面,尽管CT和MRI是常用的成像技术,但它们在准确区分真正进展与假性进展上一直存在不足。一项研究发现,在28例经病理证实为假性进展的患者中,有12例因MRI错误判断肿瘤进展而接受了不必要的手术,增加了患者的治疗风险。因此,开发更为精准的诊断技术和方法,对于优化癌症患者的治疗方案、提高治疗效果具有重要意义。
随着免疫疗法在癌症治疗中的广泛应用,精确区分真正进展与假性进展变得至关重要。尽管通过检测免疫细胞而非预期的肿瘤细胞来推断假性进展的病变活检展现出了新的可能性,但这一方法仍需结合影像学检查进行后续追踪。并且,活检本身存在局限性,因为临床医生必须排除感染和其他可能导致免疫细胞浸润增加的混淆因素。此外,活检通常只能反映组织的一小部分情况,可能无法全面代表整个组织的状况。鉴于这些限制以及活检的侵入性,我们迫切需要开发其他非侵入性的假性进展评估方法。
在监测ICI免疫反应时,PET成像技术展现出一定的应用前景。PET成像在识别接受化疗和放疗患者中的假性进展方面效果显著,并有望在未来成为ICI治疗后假性进展诊断的重要工具。一项小型回顾性研究发现,与真正进展的病变相比,氟脱氧葡萄糖(FDG)-PET成像在假性进展的肿瘤中显示的FDG摄取量明显偏低。尽管这些结果充满希望,但其他研究也揭示了这种检测方法的局限性,包括需要考虑基线代谢活动的变化以及不同癌症类型代谢活动的异质性。另一方面,超声(US)技术同样有助于假性进展的诊断。2017年一项关于黑色素瘤假性进展的病例研究显示,与基线相比,假性进展肿瘤内的血流量减少了20%。该研究指出,由于假性进展肿瘤内可量化的血流量下降,多普勒US的使用可能有助于浅表肿瘤假性进展的早期发现。
新型成像技术的研发为假性进展的诊断带来了突破性的可能性。其中,利用4-[18F]氟-1-萘酚([18F]4FN)这一药物,通过PET成像技术,我们能够选择性检测和观察天然免疫的活跃状态。这种药物在人体内的髓过氧化物酶(MPO)和H2O2氧化产物的作用下,能够选择性地与细胞和蛋白质结合。与传统成像方式不同,[18F]4FN PET成像允许医生非侵入性地评估肿瘤对ICI的反应,从而判断假性进展是否由肿瘤或免疫细胞引起。此外,另一种直接对免疫细胞进行放射性标记的方法,特别是针对T细胞的PET成像探针,已展现出在监测肿瘤内外以及全身免疫变化方面的成功应用。除了上述技术,钆对比剂增强MRI、灌注偏度和峰度的百分比变化、ferumoxytol、基于体积加权的体素多参数聚类、参数响应图,以及化疗治疗患者扩散和灌注MRI参数的间隔变化等,均为诊断化疗治疗患者的假性进展提供了希望。
综上所述,本病例中MSI-H/dMMR结直肠癌患者,最初出现临床症状明显恶化,且符合疾病进展的影像结果。尽管仅进行了两轮ICI治疗,但因其症状急剧恶化和体能状态的大幅下滑,是否出现真实疾病进展的疑虑随之而生。考虑到肿瘤体积的显著增大,我们也一度考虑将其转至临终关怀。然而,在随后的随访中,患者症状显著改善,肿瘤标志物也呈积极变化,因此我们决定继续ICI治疗。这样的临床决策非常具有挑战性,我们应综合考虑体格检查结果、相关实验室标志物,并结合自身的临床经验作出临床判断,切忌单纯依赖成像结果。随着免疫疗法在癌症治疗中的应用日益广泛,传统的病变活检和常规成像模式在诊断上的局限性更加凸显,开发能够准确区分假性进展与真实进展的先进诊断工具变得尤为迫切。虽然回顾性研究中已显示出一些希望,但仍需进一步开发非侵入性成像技术,帮助临床医生准确描述假性进展,避免不必要的治疗调整。
