- 首页 > 正文
张小田教授:胃癌精准临床研究设计的思考——从指南更迭与推动出海,谈临床智慧推动创新丨CCTB 2025
发表时间:2025-06-25 17:34:13
2025年4月11~13日,2025年CACA肿瘤标志物学术大会暨肿瘤标志物产业创新大会暨肿瘤标志物青年科学家大会暨整合肿瘤学学术会议在重庆盛大举行。期间,北京大学肿瘤医院的张小田教授以《胃癌精准临床研究设计的思考——从指南更迭与推动出海,谈临床智慧推动创新》为题进行了精彩报告。本文对此进行整理,以飨读者。
专家简介

张小田 教授
主任医师,教授,博士生导师。
现任北京大学肿瘤医院副院长,北京大学临床肿瘤学院副院长,北京市肿瘤防治研究所副所长,北京大学肿瘤医院内蒙古医院执行院长。
担任中国临床肿瘤学会胃癌专家委员会常务委员、中国抗癌协会肿瘤支持治疗委员会副主任委员、中国抗癌协会胃癌专业委员会常务委员、中国女医师协会临床肿瘤学专家委员会秘书长、北京癌症防治学会胃癌防治专家委员会主任委员等多个学术职务。
荣获中华医学科技奖一等奖等4项国家级学术奖励及中国女医师协会五洲女子科技奖、首都最美巾帼奋斗者、内蒙古突出贡献专家等十余项个人学术及教学奖励,主持12项国家级/省部级课题,主编/参编学术著作或教材31部。获“北京大学医学部优秀教师”、北京大学医学部“青年教师师德标兵”等多项教学称号,累计指导12位博士研究生,10位硕士研究生,培养进修医生80余名。
一、踏浪而行:中国创新疗法逐步走向国际前沿
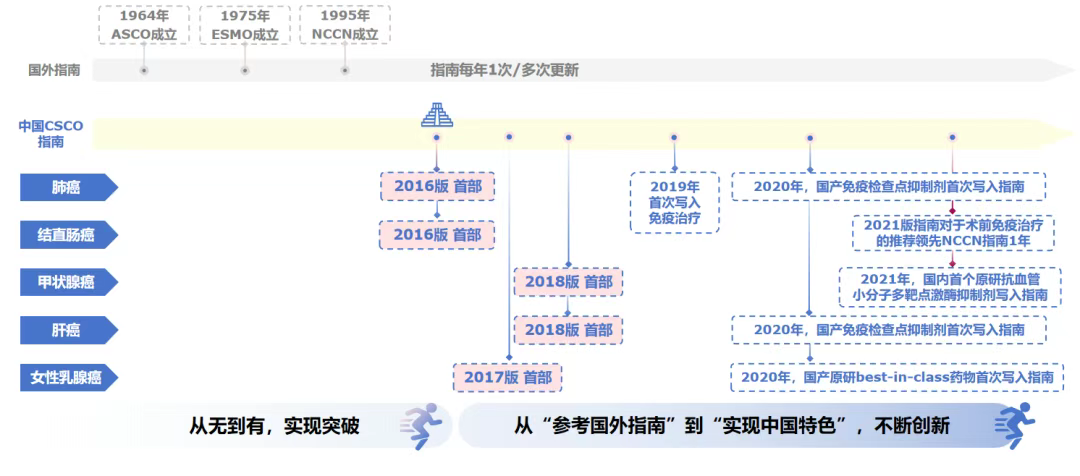
1.从模仿到超越:中国指南之路从无到有、从有到优
自1964年ASCO成立、1975年ESMO成立、1995年NCCN成立以来,国际肿瘤诊疗指南不断更新迭代。而作为知名度最高、权威性最大的医学学术性团体之一,临床肿瘤学会(CSCO)2016年才发布首部CSCO指南(即肺癌指南),此后陆续发布首部结直肠癌、甲状腺癌、肝癌、乳腺癌指南,CSCO指南实现了从无到有的突破(图1)。随着中国创新药领域的发展进步,CSCO指南开始加入中国创新疗法,从“参考国外指南”到“实现中国特色”不断创新发展,甚至赶超国外,例如,2021版结直肠癌指南对于术前免疫治疗的推荐领先NCCN指南1年。
2.中国创新疗法不断发展,走向前沿,推动全球化进程
中国创新疗法的发展逐渐成为“新质生产力”。中国临床试验数量2020年时占全球临床试验数量近1/3。至2023年,中国关键临床试验数量已赶超欧美[1]。
近五年来,我国颁布多项政策法规,进一步推动了中国创新疗法发展。中国创新疗法与国际差距逐步缩小,我国创新药企业逐步崛起,国产创新药质量不断攀升。中国创新疗法出海实现突破,药品及医疗器械领域均有许多出海成功案例:药物方面包括泽布替尼、替雷利珠单抗、西达基奥仑赛等;医疗器械方面包括图迈?腔镜手术机器人等。
中国药企海外临床试验被广泛关注。2024年有57家中国药企的164个创新药正在海外进行258项临床试验,其中12家海外临床试验数量超8个[2]。这些海外临床试验不仅为中国药企积累了宝贵的国际经验,也为中国创新疗法的国际化推广奠定了坚实基础。近年来,国外权威指南NCCN、EMSO相继纳入不同种类中国创新药,且大多数推荐等级较高。中国创新力量逐步走向世界前沿,推动全球肿瘤治疗领域的发展变革,助力肿瘤诊疗进入精准高效的新时代。
二、笃行不怠:中国创新疗法彰显临床实践信心
在不断探索与发展的进程中,中国创新疗法展现出强劲的发展势头与广阔的应用前景。一系列成果的取得,充分彰显了中国创新疗法在临床实践中的坚实信心。
讲好创新故事1:CLDN18.2
CLDN18.2是CLDN18紧密连接蛋白的胃特异性亚型。其在多种癌症中高度表达,尤其是在消化系统癌症中,40%胃癌患者表达CLDN18.2,因而成为抗肿瘤治疗的潜在靶点。临床前数据已经证明CLDN18.2 CAR-T细胞(CT041)对GC具有抗原特异性抗肿瘤作用。鉴于此,北京大学肿瘤医院沈琳教授团队开展国际最大样本量CT041治疗实体瘤Ⅰ期临床研究(临床研究注册号:NCT03874897),并分别于2022年、2024年发表了中期结果和最终结果[3-4]。对胃癌队列的分析结果显示,客观有效率较传统方案提升近10倍!CLDN18.2高表达且不伴肝、骨转移患者生存更优。Ⅱ期确证性研究(NCT04581473)——CT041治疗既往接受过治疗的CLDN18.2阳性晚期G/GEJ肿瘤的安全性、耐受性和有效性的详细数据将在2025年ASCO年会上公布。
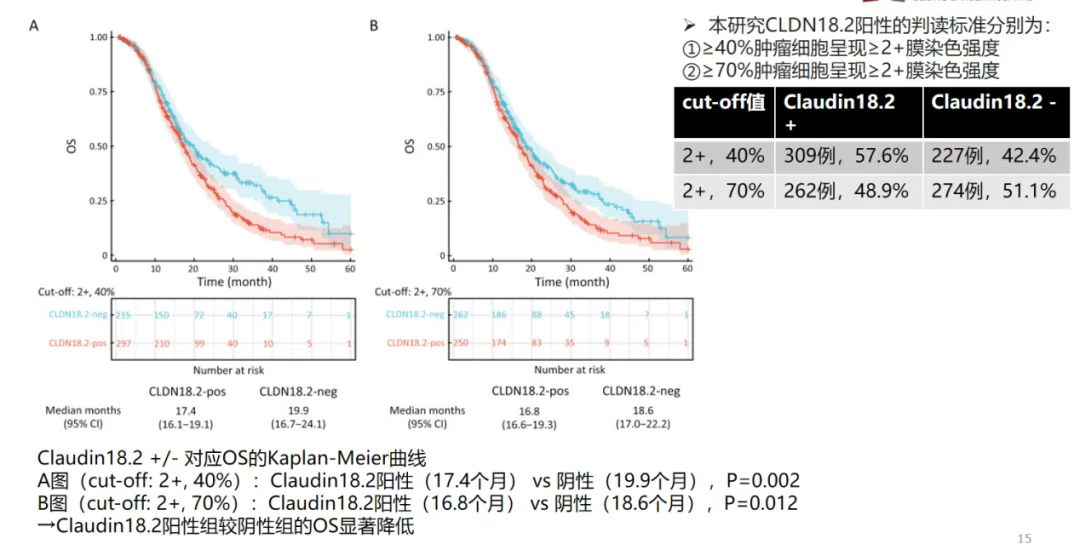
北京大学肿瘤医院沈琳教授团队的一项回顾性研究探讨了胃癌CLDN18.2阳性的临床病理意义及免疫治疗疗效[5]。分析纳入2019~2021年CT041-CG4006和CT041-ST-01临床试验中的536例晚期胃癌(GC)患者。CLDN18.2阳性的判读标准分别为:①≥40%肿瘤细胞呈现≥2+膜染色强度;②≥70%肿瘤细胞呈现≥2+膜染色强度。根据CLDN18.2的表达状态,对胃癌患者的临床病理特征和免疫治疗结果进行分析。结果显示,CLDN18.2在57.6%(cut-off值:2+,40%)和48.9%(cut-off值:2+,70%)的患者中表达。在Claudin18.2阳性表达的两个水平,Claudin18.2阳性组较阴性组的OS显著降低。纳入分析的536例患者中,83例接受了免疫治疗,分析显示,CLDN18.2阳性组较阴性组的irPFS降低。这些结果提示,CLDN18.2阳性胃癌患者生存预后不佳(图2),免疫治疗疗效不佳。
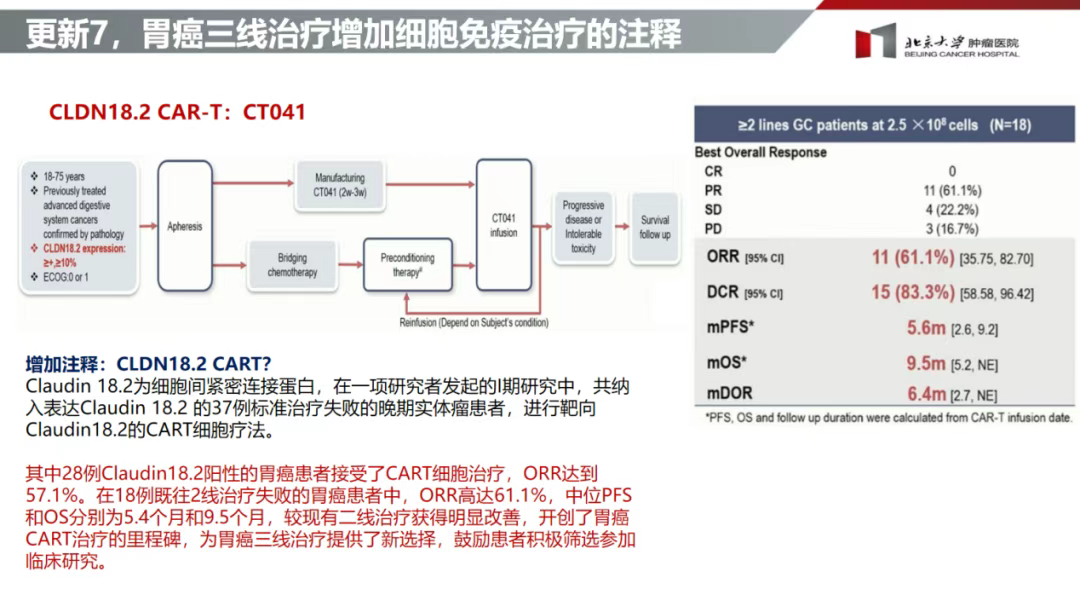
鉴于CLDN18.2 CAR-T研究方面的进展,《CSCO胃癌诊疗指南(2022版)》转移性胃癌治疗部分,增加了胃癌三线治疗增加细胞免疫治疗的注释(图3),指出研究者发起的CLDN18.2 CART的Ⅰ期研究结果开创了胃癌CART治疗的里程碑,为胃癌三线治疗提供了新选择,鼓励患者积极筛选参加临床研究[7]。2023版CSCO指南更新数据,且增加新证据,对于PD-L1 CPS≥5的HER2阴性患者,将SOX联合纳武利尤单抗列为Ⅲ级推荐;对于PD-L1 TAP≥5%的HER2阴性患者,首选XELOX联合替雷利珠单抗(1A类)[8]。
讲好创新故事-2:PD-L1单抗
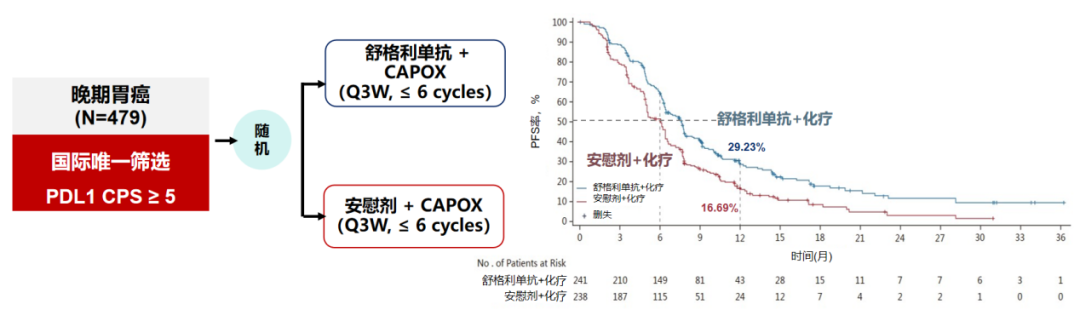
PD-L1在约80%胃癌患者中表达,是目前免疫治疗最重要的标志物。2025年2月,张小田教授等开展的GEMSTONE-303研究在JAMA重磅发表[9],该研究是国际上首次筛选PD-L1 CPS≥5分胃癌患者入组的Ⅲ期临床研究,共纳入479例晚期胃癌患者,随机分配接受舒格利单抗+CAPOX或安慰剂+CAPOX治疗,结果显示,舒格利单抗联合化疗降低疾病进展风险34%,死亡风险25%,生存期延长3个月(图4),从而使舒格利单抗成为获批国际唯一的PD-L1单抗胃癌适应证。
2024版CSCO胃癌诊疗指南对于HER2阴性胃癌的一线免疫治疗中,新增CPS≥5 CAPOX联合舒格利单抗1A类证据/l级推荐(303研究)。此外,本版指南还新增CPS≥1 CAPOX/FP联合帕博利珠单抗1A类证据/l级推荐(KN859研究);对于PD-L1 TAP<5%或检测不可及,更改为XELOX或FP联合替雷利珠单抗(1B类证据/Ⅱ级推荐)[10]。
CheckMate-649、KEYNOTE-859、ORIENT-16、RATIONALE-305等RCT研究建立了晚期胃癌一线化免联合治疗模式[11-14]。这些研究中,整体人群OS的HR在0.77~0.80,PD-1单抗联合化疗在含铂双药化疗基础上延长整体人群OS约1.4~2.9个月。然而,这些研究的入组人群均为未选择基线PD-L1表达水平的全人群。各项RCT不同PD-L1 CPS亚组分析显示,相较于高表达亚组,PD-1抑制剂在CPS<1或CPS<15的亚组的OS获益趋势并不明显[11-13]。这引出一个临床问题:PD-1单抗使胃癌全人群获益吗?如果为否,获益人群是哪些?
2024年9月26日肿瘤药物咨询委员会召开会议讨论免疫检查点抑制剂在不可切除或转移性胃和胃食管结合部腺癌患者中的使用,并得出结论:对于PD-L1 CPS<1的胃癌患者使用PD-1抑制剂并不获益,PD-L1<10患者获益结果不一致[15]。
追溯原因,PD-1/PD-L1抑制剂作用靶点和机制并不相同。PD-1抑制剂的靶细胞为T细胞,阻断PD-1与PD-L1/PD-L2的结合,恢复活化的T细胞杀伤能力,同时也阻断了T细胞表面PD-1与其他免疫细胞表面PD-L1/L2的结合,潜在增加免疫反应风险。PD-L1抑制剂的靶细胞为肿瘤细胞,其同时结合肿瘤细胞与抗原呈递细胞表面的PD-L1,阻断PD-1与PD-L1结合,且不影响PD-L2的生理功能[16]。因此,在预测免疫治疗是否获益、获益大小时,还是需考虑PD-L1阳性的表达水平。GEMSTONE-101早期研究也验证了这一点,在所有的舒格利单抗+标准化疗组中,均观察到令人鼓舞的疗效,ORR在47.6%~75.0%。而探索性亚组分析提示,在GAC/GEJAC队列,PD-L1表达CPS≥5的患者中可能效果更好(CPS≥5 vs. CPS<5,ORR:63.2% vs. 57.1%)[17]。
因此,《CSCO胃癌诊疗指南(2025版)》做出更新,更改帕博利珠单抗I级推荐的PDL1表达人群,从CPS≥10分更改为CPS≥5分,Ⅱ级推荐从CPS<10分更改为CPS<5分或检测不可及(1A类证据);新增无论PD-L1表达状态:XELOX联合卡度尼利单抗为I级推荐(1A类证据);注释f中增加对应KEYNOTE-859研究CPS≥5分相关证据的描述[18]。COMPASSION-15研究是由北京大学肿瘤医院季加孚教授和沈琳教授作为主要研究者的一项随机、双盲、Ⅲ期研究,旨在探讨全球首个PD-1/CTLA-4双特异性抗体卡度尼利单抗联合化疗一线治疗HER2阴性晚期胃或胃食管结合部(G/GEJ)腺癌的效果。季加孚教授曾于2024年AACR上公布其初步结果[19]。2025年1月,以沈琳教授为第一作者的COMPASSION-15研究全文登顶国际权威杂志Nature medicine。更新的OS数据显示,在ITT人群,卡度尼利单抗组较安慰剂组的中位OS显著延长[HR 0.66(95%CI:0.54~0.81),中位OS 14.1个月 vs. 11.1个月;P<0.001],在PD-L1 CPS≥5亚组也观察到卡度尼利单抗组OS显著获益[HR 0.58(0.41~0.82),中位OS 15.3个月 vs. 10.9个月;P<0.001];而在PD-L1 CPS<5亚组,卡度尼利单抗也表现出OS改善的趋势(图5)。COMPASSION-15研究的全文发表再次为全球肿瘤治疗领域贡献了中国创新治疗方案[20]。
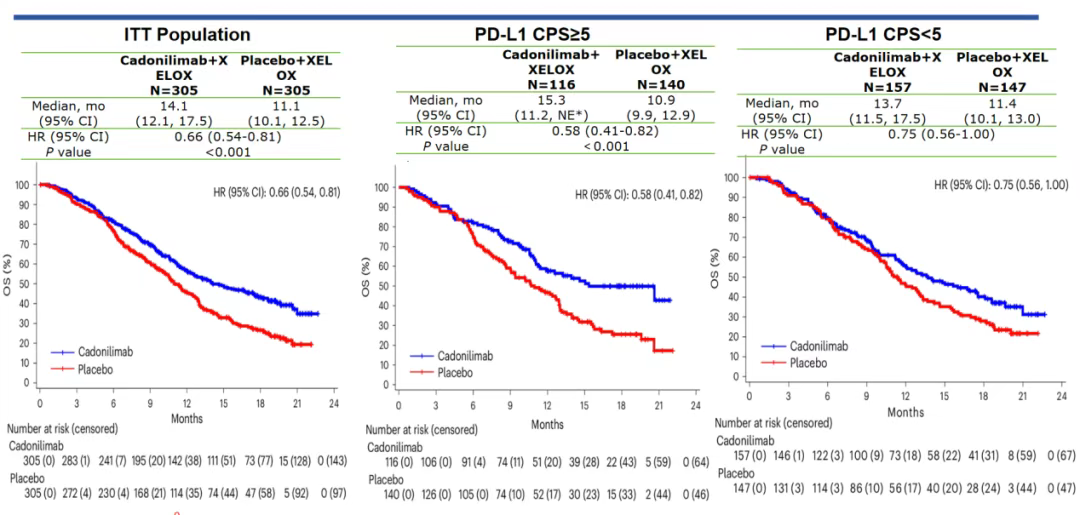
图5. COMPASSION-15研究全文OS更新数据
三、未来展望:中国创新疗法机遇与挑战并存
中国创新药预计将在快跟创新的1.0时代,联合疗法、适应证拓展的2.0时代以及探索全新靶点、新技术的3.0时代三类创新中逐步爆发。
当前“已验证靶点或临床阶段靶点的快跟”仍是中国创新的主要形式。中国创新疗法仍以大分子(49%)和小分子(43%)为主旋律。多项中国创新疗法实现出海突破,中国创新药物更多瘤种适应证在全球获批,多项创新研究和创新疗法被纳入国际指南,彰显了中国创新药与中国研究者的国际影响力。
近几年中国创新药正逐渐进入探索新靶点与新技术的3.0时代。中国团队已发现多个新靶点,如癌症免疫疗法中的CD300ld、2型糖尿病中的THADA、自身免疫性疾病中的Nsun2)等。未来出海方向中,双抗仍是重要领域,包括细胞桥接、双靶点阻断、双免疫靶点协同等技术,此外,还有ADC、抗体偶联物、溶瘤病毒、疫苗等领域可能也是出海热点。未来道阻且长,但探索创新不会止步。
参考文献
1.Wang F, et al. Cell. 2024 Mar 28;187(7):1578-1583.
2.2024年中国创新药械出海趋势与策略白皮书
3.Changsong Qi, et al. Nat Med. 2022 Jun;28(6):1189-1198.
4.Changsong Qi, et al. Nat Med. 2024 Aug;30(8):2224-2234.
5.Changsong Qi, et al. Chin J Cancer Res. 2024 Feb 29;36(1):78-89.
6.Keren Jia, et al. BMC Med. 2022 Jul 11;20(1):223.
7.CSCO胃癌诊疗指南(2022版).
8.CSCO胃癌诊疗指南(2023版).
9.Xiaotian Zhang, et al. JAMA. 2025;333(15):1305-1314.
10.CSCO胃癌诊疗指南(2024版).
11.Yelena Y Janjigian, et al. Lancet. 2021;398:27-40.
12.Sun Young Rha, et al. Lancet Oncol. 2023;24:1181-1195.
13.Jianming Xu, et al. JAMA.2023;330:2064-2074.
14.Miao-Zhen Qiu, et al. BMJ. 2024;385:e078876.
15.September 26, 2024: Meeting of the Oncologic Drugs Advisory Committee Meeting Announcement - 09/26/2024 | FDA
16.Immunotherapy. 2019 Apr;11(5):429-441.doi: 10.2217/imt-2018-0110
17.Cancer Immunol Immunother. 2022;71(8):1897-1908.
18.CSCO胃癌诊疗指南(2025版).
19.Jiafu J, et al. 2024 AACR. Abstract CT006.
20.Shen, Lin et al. Nature medicine, 10.1038/s41591-024-03450-4. 22 Jan. 2025.
- 推荐文章
