- 首页 > 正文
邓薇教授纵论靶免联合治疗在胃癌围手术期的探索与前景
发表时间:2025-06-25 22:30:01
近年来,胃癌围手术期治疗虽取得显著进展,但仍面临疗效差异大、耐药性高、治疗完成率低等临床挑战。随着免疫治疗与靶向药物的快速发展,靶免联合治疗这一多模态策略为胃癌患者带来了新的希望。从冷肿瘤微环境重塑到HER2/MSI-H人群的精准干预,从KEYNOTE-811到NEONIPIGA研究的突破性成果,靶免联合治疗正逐步改写胃癌围手术期的治疗格局。
在此背景下,北京友谊医院邓薇教授围绕“靶免联合治疗在胃癌围手术期的探索与前景”,从冷热肿瘤的微环境调控、关键靶点选择、临床研究证据到个体化治疗策略等方面,深入剖析了当前进展与未来方向,为临床实践提供了宝贵的经验与指导。《肿瘤瞭望消化时讯》特将精彩内容整理如下,以飨读者。
专家简介

一、胃癌围手术期治疗的困境与挑战
围手术期治疗(perioperative therapy)已成为局部晚期胃癌(LAGC)标准治疗的重要组成部分,意在通过术前新辅助治疗缩小肿瘤、提高手术R0切除率,并通过术后辅助治疗以降低复发风险[1]。
尽管已有FLOT、SOX等多种推荐方案,临床应用中仍面临多重困境[2~7](图1、2):
疗效差异显著:由于胃癌生物学异质性强,部分患者对新辅助化疗反应不佳,治疗后肿瘤降期不充分,难以获得根治性手术机会。新辅助期间疾病进展:约10%~20%患者在化疗过程中病情进展,失去手术窗口,提示部分人群原发耐药。术后辅助治疗完成率低:术后体能下降、毒性耐受性差导致辅助治疗往往难以完成,进一步影响长期疗效。缺乏精准分层:目前缺乏有效的生物标志物筛选机制,无法实现个体化治疗决策。
由此可见,单纯依赖传统化疗方案难以全面满足LAGC患者的治疗需求,亟需引入更高效、更精准的新策略。
二、“冷热肿瘤”:决定免疫治疗反应的关键因素
在胃癌等多种实体瘤中,肿瘤对免疫治疗的反应存在显著差异。近年来,“冷热肿瘤”这一免疫微环境分型的概念逐渐成为预测免疫治疗疗效和制定联合治疗策略的重要考量因素。
热肿瘤与冷肿瘤的免疫特征
在免疫治疗的实践中,肿瘤微环境(TME)的“冷”与“热”状态被认为是影响免疫检查点抑制剂(ICIs)疗效的关键因素。不同类型肿瘤在免疫原性、抗原呈递、T细胞浸润及免疫抑制机制等方面存在显著差异[9、11]。
冷肿瘤的生物学特征冷肿瘤免疫原性低、抗原呈递能力差,T细胞难以浸润,且微环境中免疫抑制细胞丰富,形成“免疫沙漠”。主要表现包括:
缺乏新抗原或HLA表达缺陷,T细胞识别受限;树突细胞功能障碍,影响抗原呈递;趋化因子少、血管和基质屏障重,限制T细胞进入;含大量免疫抑制细胞(如TAM、MDSC、Tregs),抑制T细胞活性。
热肿瘤的生物学特征热肿瘤免疫活性高,TME中免疫细胞丰富,具备良好免疫反应基础,表现为:
CD8+ T细胞大量浸润,有效识别并杀伤肿瘤;NK细胞参与协同攻击,增强免疫强度和覆盖面。
冷热肿瘤的微环境特征直接决定了其对免疫治疗的敏感性。理解并调控TME“由冷转热”的过程,正在成为提高胃癌等实体瘤免疫治疗反应率的重要研究方向。
冷肿瘤的微环境可通过联合治疗策略改善
研究表明,冷肿瘤并非绝对无法应答免疫治疗。通过联合其他治疗方式,有可能改变其免疫微环境,从而增强免疫治疗效果(图3、4)。常见的策略包括:
抗血管生成治疗(如阿帕替尼)能通过重塑血管、减轻缺氧、抑制免疫抑制细胞,改善免疫细胞的浸润能力;放疗、化疗或靶向治疗可促进肿瘤抗原释放,激活树突状细胞,提高抗原递呈效率,为免疫反应建立基础。
这些方法能够逐步实现“由冷转热”的治疗目标,为原本缺乏免疫反应的患者创造ICI介入的机会。
在胃癌人群中,典型热肿瘤的比例相对较低。MSI-H、EBV阳性或PD-L1 CPS≥5的患者比例有限,绝大多数属于“冷”或“免疫排斥型”肿瘤[12、13]。因此,仅依靠PD-1抑制剂单药治疗,临床疗效往往不理想。
对于这类患者,靶向药物联合免疫治疗,再加上化疗等多模态干预,可能成为更具前景的治疗路径。此类组合策略不仅有望改造免疫微环境,还能实现全身性疾病控制,从而提升治疗获益。
三、靶向+免疫+化疗:三重组合,为胃癌治疗打开新局面
在胃癌治疗领域,“靶向+免疫”联合化疗的策略正逐渐展现出强大的协同效应。通俗来说,就是通过识别肿瘤的“弱点”(即分子靶点),联合使用三类作用机制不同的药物——靶向药物、免疫药物和传统化疗——形成互补、协同、增效的治疗组合。
靶点+组合:找到肿瘤的“要害”
目前在胃癌中已明确的治疗靶点包括[14]:
HER2(人类表皮生长因子受体2):调控肿瘤生长和转移,与肿瘤的侵袭性密切相关;VEGF(血管内皮生长因子):促进肿瘤“建血管”,为其提供营养与通路。
在部分晚期胃癌患者中,抗VEGF类靶向药联合化疗已显示出一定疗效。同时,研究发现,曲妥珠单抗(HER2靶向药)可诱导肿瘤表达PD-L1,从而增强免疫治疗的效果。而免疫检查点抑制剂(如PD-1/PD-L1抗体)不仅能解除肿瘤的免疫抑制,还可能改善肿瘤微环境,增强抗血管生成的靶向治疗效果[15、16]。三种机制协同作战,有望打破单一治疗的天花板。
HER2阳性胃癌:KEYNOTE-811打开治疗新模式
HER2阳性的胃癌通常更具侵袭性、转移早、复发率高,是治疗难点之一。2021年发布的KEYNOTE-811研究为这类患者带来了新的希望。
该研究是一项国际多中心的Ⅲ期临床试验,针对局部晚期不可切除或已转移的HER2阳性胃癌患者,比较了帕博利珠单抗(免疫)+曲妥珠单抗(HER2靶向)+化疗vs. 曲妥珠单抗+化疗的疗效。
结果显示:三联治疗组的中位总生存期达20.0个月,明显优于对照组(16.8个月);而在PD-L1表达水平较高(CPS≥1)的患者中,生存期进一步延长至20.1个月,表明HER2状态与PD-L1水平的联合评估,可能帮助筛选更适合“靶免化”治疗的患者[17、18](图5)。
MSI-H人群:免疫+靶向也能“先下手为强”
除了HER2,MSI-H/dMMR(高微卫星不稳定/错配修复缺陷)也是胃癌中另一个重要的免疫敏感人群,部分研究开始尝试在这类患者中引入“围手术期免疫治疗”,并取得了可观的成果。
NEONIPIGA研究:一项Ⅱ期研究,评估新辅助纳武利尤单抗+伊匹木单抗、术后纳武利尤单抗维持治疗在dMMR/MSI-H可切除胃癌患者中的应用。结果令人鼓舞:R0切除率100%,病理完全缓解(pCR)率达58.6%,并且在中位随访期内无复发或死亡报告,显示出极强的治疗潜力[19](图6)。DANTE研究:一项多中心、随机的Ⅱb期研究,探索PD-L1抗体阿替利珠单抗联合FLOT方案在可切除胃癌患者围手术期的效果。研究发现联合组病理缓解率显著提高,尤其在PD-L1 CPS≥10或MSI阳性的亚组中疗效更加突出。且两组在术后并发症和不良事件方面差异不大,提示方案安全性可控[20](图7)。
从KEYNOTE-811到NEONIPIGA和DANTE,我们可以看到,针对胃癌的围手术期治疗正逐步从“一刀切”走向“分层精准”——结合HER2、PD-L1、MSI等多种分子特征,制定个体化的靶免联合治疗方案,正在成为一种可行的新方向。未来,如何进一步明确人群、优化方案,并提升治疗的安全性和可及性,仍是临床实践中亟需解决的问题。
阿帕替尼作为VEGFR2抑制剂,具备抗血管生成和免疫调节的双重作用,可改善肿瘤免疫抑制微环境,从而为免疫治疗“创造条件”[21](图8)。
多个国内研究团队开展了PD-1/PD-L1抗体+阿帕替尼+SOX化疗的转化治疗探索:
四、临床实践中的若干关键问题
尽管围手术期免疫治疗在胃癌中的研究取得了初步进展,但在实际应用过程中仍面临多个尚未解决的关键问题,主要包括以下几点:
疗效预测仍不精准:PD-L1、MSI等标志物存在局限,不能准确识别获益人群,亟需建立更综合的预测模型。治疗时机与疗程无统一标准:不同研究免疫治疗的起始时间和周期差异大,缺乏公认规范。疗效评估方法不够理想:传统影像标准可能低估疗效,难以判断“假进展”;缺乏敏感、早期的评价手段。安全性与可及性待权衡:免疫相关不良反应及治疗成本高,临床需在疗效、安全和经济之间取得平衡。
五、展望未来:向个体化与治愈性转化迈进
随着精准医学和免疫肿瘤学的发展,胃癌围手术期治疗正从“以病理分期为中心”逐步转向“以分子特征为基础”的个体化治疗阶段。
靶免联合策略,作为连接系统治疗与手术治疗的重要桥梁,有望在以下人群中扮演关键角色:
MSI-H/dMMR患者:初步数据已显示显著病理缓解,或可尝试“免手术”策略;高PD-L1表达:可能更易从免疫激活中获益;边界可切除/潜在转化人群:通过多模态治疗实现R0切除,突破手术局限。
未来,围手术期治疗将不仅关注“是否可切”,更聚焦于“如何切得更彻底、切得更值得”,真正实现从“降期”到“治愈”的质变跨越。
参考文献(上下滑动可查看)
[1]?Sung H, Ferlay J.Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021: 71: 209-249.[2]?CUNNINGHAM D, ALLUM W H, STENNING S P, et al. N Engl J Med. 2006; 355(1): 11-20.
[3]?Ychou M,Boige V,Pignon JP,et al. J Clin Oncol,2011,29(13): 1715-1721.
[4]?Al-Batran SE,Hofheinz RD,Pauligk C,et al. Lancet Oncol,2016,17(12): 1697-1708.
[5]?Iwasaki Y , Terashima M , Mizusawa J ,et al. Gastric Cancer, 2021,24(2):492-502.
[6]?Zhang X,Liang H,Li Z,et al. Lancet Oncol,2021,22(8): 1081-1092.
[7]?Kang YK,Yook JH,Park YK,et al. J Clin Oncol,2021,39(26): 2903-2913.
[8]?中国临床肿瘤学会(CSCO)胃癌诊疗指南2024.
[9]?Gastric Cancer, Version 2024, NCCN Clinical Practice Guidelines in Oncology.?
[10]?Petricevic B, Kabiljo J, Zirnbauer R, et al. Semin Cancer Biol, 2022,86(Pt 2):834-850.
[11]?Qingzhu Jia, Aoyun Wang, Yixiao Yuan,et al. Exp Hematolo ?Oncol ,2022.11(1):24.
[12]?Adam JB, Vesteinn T, Ilya S, et al. Nature, 2014, 513(7517): 202‐209.
[13]?Cristescu R, Lee J, Nebozhyn M, et al. Nat Med, 2015, 21(5):449‐456.?
[14]?Yoshiaki Nakamura,et al. Nature reviews CliniCal On COlOgy 2021 Aug;18(8):473-487.
[15]?王梦雨, 等. 中国肿瘤临床. 2022, 49(15):801-806.
[16]?王一橙, 李洋, 刘光艺. 中国普外基础与临床杂志. 2023;30(x):1-9.
[17]?Janjigian YY, Kawazoe A, Bai Y, et al; KEYNOTE-811 Investigators. Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet. 2023 Dec 9;402(10418):2197-2208.?
[18]?Sara Lonardi, et al. 2024 ESMO Abs14000.
[19]?André T, et al. J Clin Oncol. 2023 Jan 10;41(2):255-265.
[20]?Lorenzen S, G?tze TO, Thuss-Patience P, et al.J Clin Oncol, 2024,42(4):410-420
[21]?Khan, K. A., & Kerbel, R. S. (2018).. Nature Reviews Clinical Oncology, 15(5), 310–324.
[22]?Li S, et al. Nat Commun. 2023 Jan 3;14(1):8. doi: 10.1038/s41467-022-35431-x.
[23]?C. Li, Y. Zheng, et al. 2023 ESMO. 1512MO.
在此背景下,北京友谊医院邓薇教授围绕“靶免联合治疗在胃癌围手术期的探索与前景”,从冷热肿瘤的微环境调控、关键靶点选择、临床研究证据到个体化治疗策略等方面,深入剖析了当前进展与未来方向,为临床实践提供了宝贵的经验与指导。《肿瘤瞭望消化时讯》特将精彩内容整理如下,以飨读者。
专家简介

邓 薇主任
医师,副教授,研究生导师
北京友谊医院 ?国家消化疾病中心
普外分中心化疗病区
毕业于北京大学医学部,获肿瘤内科博士
中国老年保健协会消化系统疾病诊疗分会常务委员
中国临床肿瘤学会(CSCO)青年专家委员会委员
中国临床肿瘤学会(CSCO)胆系肿瘤专家委员会委员
中国抗癌协会(CACA)大肠癌专委会青年委员会委员
北京医师协会肿瘤专业专家委员会青年委员会委员
北京医师协会结直肠疾病专科医师分会理事会理事
《肿瘤综合治疗电子杂志》编委
独立主持课题有国家自然科学基金、北京市自然基金等
以第一和通讯作者发表SCI论文20余篇
一、胃癌围手术期治疗的困境与挑战
围手术期治疗(perioperative therapy)已成为局部晚期胃癌(LAGC)标准治疗的重要组成部分,意在通过术前新辅助治疗缩小肿瘤、提高手术R0切除率,并通过术后辅助治疗以降低复发风险[1]。
尽管已有FLOT、SOX等多种推荐方案,临床应用中仍面临多重困境[2~7](图1、2):
疗效差异显著:由于胃癌生物学异质性强,部分患者对新辅助化疗反应不佳,治疗后肿瘤降期不充分,难以获得根治性手术机会。新辅助期间疾病进展:约10%~20%患者在化疗过程中病情进展,失去手术窗口,提示部分人群原发耐药。术后辅助治疗完成率低:术后体能下降、毒性耐受性差导致辅助治疗往往难以完成,进一步影响长期疗效。缺乏精准分层:目前缺乏有效的生物标志物筛选机制,无法实现个体化治疗决策。
由此可见,单纯依赖传统化疗方案难以全面满足LAGC患者的治疗需求,亟需引入更高效、更精准的新策略。
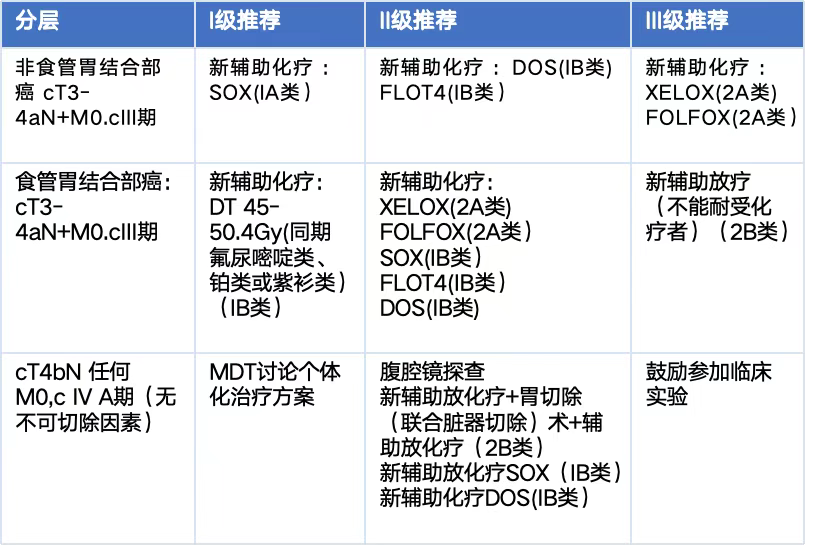
图1. 2024年CSCO指南可切除胃癌的围手术期治疗新辅助治疗推荐[8]
图2. 2024年NCCN指南可切除胃癌的围手术期治疗新辅助治疗推荐[9]
二、“冷热肿瘤”:决定免疫治疗反应的关键因素
在胃癌等多种实体瘤中,肿瘤对免疫治疗的反应存在显著差异。近年来,“冷热肿瘤”这一免疫微环境分型的概念逐渐成为预测免疫治疗疗效和制定联合治疗策略的重要考量因素。
热肿瘤与冷肿瘤的免疫特征
在免疫治疗的实践中,肿瘤微环境(TME)的“冷”与“热”状态被认为是影响免疫检查点抑制剂(ICIs)疗效的关键因素。不同类型肿瘤在免疫原性、抗原呈递、T细胞浸润及免疫抑制机制等方面存在显著差异[9、11]。
冷肿瘤的生物学特征冷肿瘤免疫原性低、抗原呈递能力差,T细胞难以浸润,且微环境中免疫抑制细胞丰富,形成“免疫沙漠”。主要表现包括:
缺乏新抗原或HLA表达缺陷,T细胞识别受限;树突细胞功能障碍,影响抗原呈递;趋化因子少、血管和基质屏障重,限制T细胞进入;含大量免疫抑制细胞(如TAM、MDSC、Tregs),抑制T细胞活性。
热肿瘤的生物学特征热肿瘤免疫活性高,TME中免疫细胞丰富,具备良好免疫反应基础,表现为:
CD8+ T细胞大量浸润,有效识别并杀伤肿瘤;NK细胞参与协同攻击,增强免疫强度和覆盖面。
冷热肿瘤的微环境特征直接决定了其对免疫治疗的敏感性。理解并调控TME“由冷转热”的过程,正在成为提高胃癌等实体瘤免疫治疗反应率的重要研究方向。
冷肿瘤的微环境可通过联合治疗策略改善
研究表明,冷肿瘤并非绝对无法应答免疫治疗。通过联合其他治疗方式,有可能改变其免疫微环境,从而增强免疫治疗效果(图3、4)。常见的策略包括:
抗血管生成治疗(如阿帕替尼)能通过重塑血管、减轻缺氧、抑制免疫抑制细胞,改善免疫细胞的浸润能力;放疗、化疗或靶向治疗可促进肿瘤抗原释放,激活树突状细胞,提高抗原递呈效率,为免疫反应建立基础。
这些方法能够逐步实现“由冷转热”的治疗目标,为原本缺乏免疫反应的患者创造ICI介入的机会。

图3. 新辅助治疗和辅助治疗在诱导抗肿瘤免疫反应方面的差异
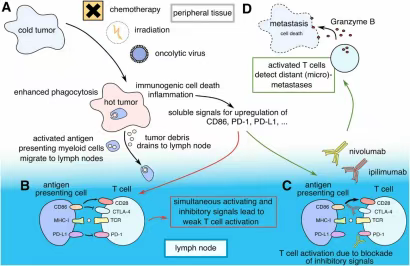
图4. 联合ICI治疗有利于激活全身性抗肿瘤免疫反应
对于这类患者,靶向药物联合免疫治疗,再加上化疗等多模态干预,可能成为更具前景的治疗路径。此类组合策略不仅有望改造免疫微环境,还能实现全身性疾病控制,从而提升治疗获益。
三、靶向+免疫+化疗:三重组合,为胃癌治疗打开新局面
在胃癌治疗领域,“靶向+免疫”联合化疗的策略正逐渐展现出强大的协同效应。通俗来说,就是通过识别肿瘤的“弱点”(即分子靶点),联合使用三类作用机制不同的药物——靶向药物、免疫药物和传统化疗——形成互补、协同、增效的治疗组合。
靶点+组合:找到肿瘤的“要害”
目前在胃癌中已明确的治疗靶点包括[14]:
HER2(人类表皮生长因子受体2):调控肿瘤生长和转移,与肿瘤的侵袭性密切相关;VEGF(血管内皮生长因子):促进肿瘤“建血管”,为其提供营养与通路。
在部分晚期胃癌患者中,抗VEGF类靶向药联合化疗已显示出一定疗效。同时,研究发现,曲妥珠单抗(HER2靶向药)可诱导肿瘤表达PD-L1,从而增强免疫治疗的效果。而免疫检查点抑制剂(如PD-1/PD-L1抗体)不仅能解除肿瘤的免疫抑制,还可能改善肿瘤微环境,增强抗血管生成的靶向治疗效果[15、16]。三种机制协同作战,有望打破单一治疗的天花板。
HER2阳性胃癌:KEYNOTE-811打开治疗新模式
HER2阳性的胃癌通常更具侵袭性、转移早、复发率高,是治疗难点之一。2021年发布的KEYNOTE-811研究为这类患者带来了新的希望。
该研究是一项国际多中心的Ⅲ期临床试验,针对局部晚期不可切除或已转移的HER2阳性胃癌患者,比较了帕博利珠单抗(免疫)+曲妥珠单抗(HER2靶向)+化疗vs. 曲妥珠单抗+化疗的疗效。
结果显示:三联治疗组的中位总生存期达20.0个月,明显优于对照组(16.8个月);而在PD-L1表达水平较高(CPS≥1)的患者中,生存期进一步延长至20.1个月,表明HER2状态与PD-L1水平的联合评估,可能帮助筛选更适合“靶免化”治疗的患者[17、18](图5)。
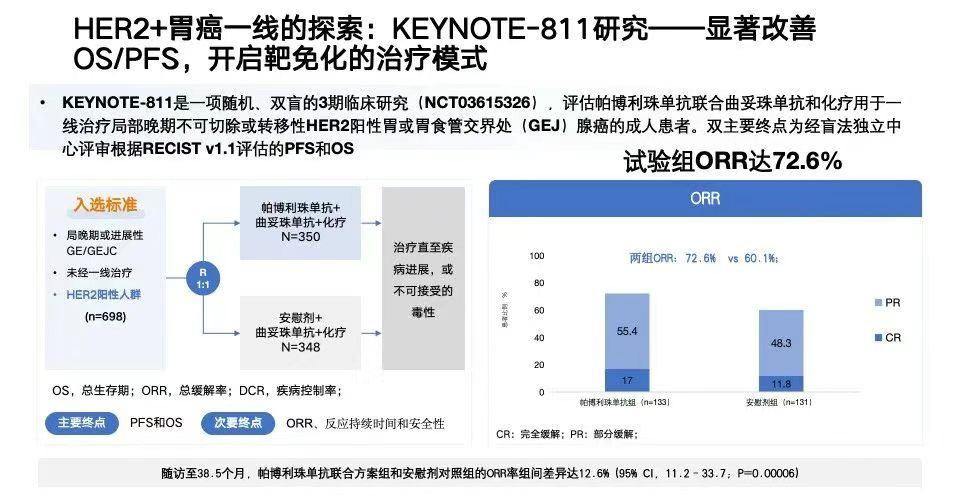
图5. KEYNOTE-811研究
除了HER2,MSI-H/dMMR(高微卫星不稳定/错配修复缺陷)也是胃癌中另一个重要的免疫敏感人群,部分研究开始尝试在这类患者中引入“围手术期免疫治疗”,并取得了可观的成果。
NEONIPIGA研究:一项Ⅱ期研究,评估新辅助纳武利尤单抗+伊匹木单抗、术后纳武利尤单抗维持治疗在dMMR/MSI-H可切除胃癌患者中的应用。结果令人鼓舞:R0切除率100%,病理完全缓解(pCR)率达58.6%,并且在中位随访期内无复发或死亡报告,显示出极强的治疗潜力[19](图6)。DANTE研究:一项多中心、随机的Ⅱb期研究,探索PD-L1抗体阿替利珠单抗联合FLOT方案在可切除胃癌患者围手术期的效果。研究发现联合组病理缓解率显著提高,尤其在PD-L1 CPS≥10或MSI阳性的亚组中疗效更加突出。且两组在术后并发症和不良事件方面差异不大,提示方案安全性可控[20](图7)。
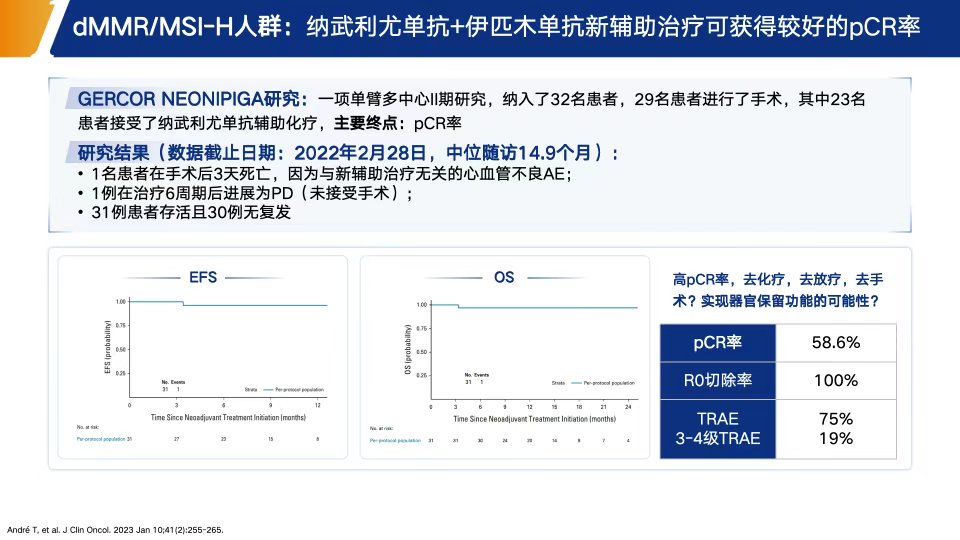
图6. GERCOR NEONIPIGA研究结果
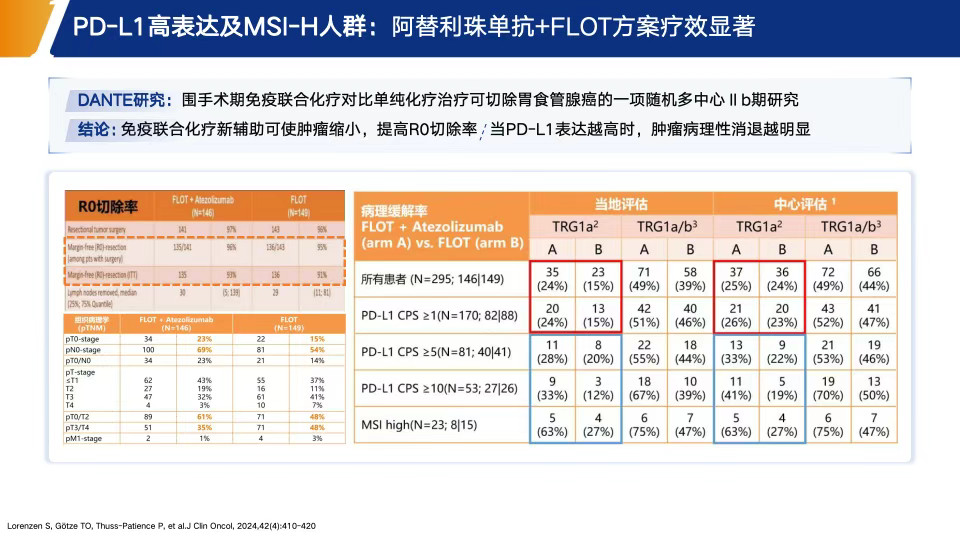
图7. DANTE研究结果
从KEYNOTE-811到NEONIPIGA和DANTE,我们可以看到,针对胃癌的围手术期治疗正逐步从“一刀切”走向“分层精准”——结合HER2、PD-L1、MSI等多种分子特征,制定个体化的靶免联合治疗方案,正在成为一种可行的新方向。未来,如何进一步明确人群、优化方案,并提升治疗的安全性和可及性,仍是临床实践中亟需解决的问题。
阿帕替尼作为VEGFR2抑制剂,具备抗血管生成和免疫调节的双重作用,可改善肿瘤免疫抑制微环境,从而为免疫治疗“创造条件”[21](图8)。
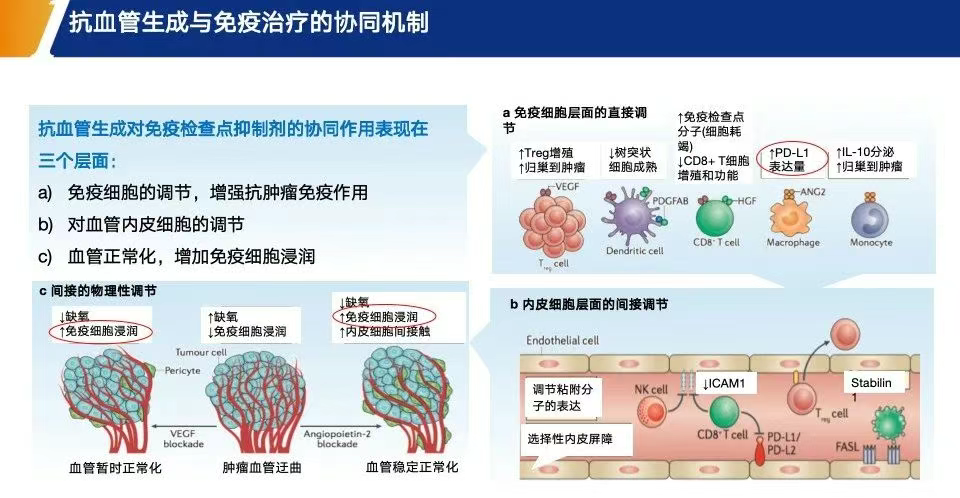
图8. 抗血管生成与免疫治疗的协同机制
在进展期不可切除胃癌患者中,该三联方案可显著缩小病灶,部分患者成功实现R0切除;病理主要缓解率(MPR)和完全缓解率(pCR)明显高于传统方案,部分研究pCR率接近20%[22、23](图9)。

图9. DRAGON IV/CAP 05研究结果
四、临床实践中的若干关键问题
尽管围手术期免疫治疗在胃癌中的研究取得了初步进展,但在实际应用过程中仍面临多个尚未解决的关键问题,主要包括以下几点:
疗效预测仍不精准:PD-L1、MSI等标志物存在局限,不能准确识别获益人群,亟需建立更综合的预测模型。治疗时机与疗程无统一标准:不同研究免疫治疗的起始时间和周期差异大,缺乏公认规范。疗效评估方法不够理想:传统影像标准可能低估疗效,难以判断“假进展”;缺乏敏感、早期的评价手段。安全性与可及性待权衡:免疫相关不良反应及治疗成本高,临床需在疗效、安全和经济之间取得平衡。
五、展望未来:向个体化与治愈性转化迈进
随着精准医学和免疫肿瘤学的发展,胃癌围手术期治疗正从“以病理分期为中心”逐步转向“以分子特征为基础”的个体化治疗阶段。
靶免联合策略,作为连接系统治疗与手术治疗的重要桥梁,有望在以下人群中扮演关键角色:
MSI-H/dMMR患者:初步数据已显示显著病理缓解,或可尝试“免手术”策略;高PD-L1表达:可能更易从免疫激活中获益;边界可切除/潜在转化人群:通过多模态治疗实现R0切除,突破手术局限。
未来,围手术期治疗将不仅关注“是否可切”,更聚焦于“如何切得更彻底、切得更值得”,真正实现从“降期”到“治愈”的质变跨越。
参考文献(上下滑动可查看)
[1]?Sung H, Ferlay J.Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2021: 71: 209-249.[2]?CUNNINGHAM D, ALLUM W H, STENNING S P, et al. N Engl J Med. 2006; 355(1): 11-20.
[3]?Ychou M,Boige V,Pignon JP,et al. J Clin Oncol,2011,29(13): 1715-1721.
[4]?Al-Batran SE,Hofheinz RD,Pauligk C,et al. Lancet Oncol,2016,17(12): 1697-1708.
[5]?Iwasaki Y , Terashima M , Mizusawa J ,et al. Gastric Cancer, 2021,24(2):492-502.
[6]?Zhang X,Liang H,Li Z,et al. Lancet Oncol,2021,22(8): 1081-1092.
[7]?Kang YK,Yook JH,Park YK,et al. J Clin Oncol,2021,39(26): 2903-2913.
[8]?中国临床肿瘤学会(CSCO)胃癌诊疗指南2024.
[9]?Gastric Cancer, Version 2024, NCCN Clinical Practice Guidelines in Oncology.?
[10]?Petricevic B, Kabiljo J, Zirnbauer R, et al. Semin Cancer Biol, 2022,86(Pt 2):834-850.
[11]?Qingzhu Jia, Aoyun Wang, Yixiao Yuan,et al. Exp Hematolo ?Oncol ,2022.11(1):24.
[12]?Adam JB, Vesteinn T, Ilya S, et al. Nature, 2014, 513(7517): 202‐209.
[13]?Cristescu R, Lee J, Nebozhyn M, et al. Nat Med, 2015, 21(5):449‐456.?
[14]?Yoshiaki Nakamura,et al. Nature reviews CliniCal On COlOgy 2021 Aug;18(8):473-487.
[15]?王梦雨, 等. 中国肿瘤临床. 2022, 49(15):801-806.
[16]?王一橙, 李洋, 刘光艺. 中国普外基础与临床杂志. 2023;30(x):1-9.
[17]?Janjigian YY, Kawazoe A, Bai Y, et al; KEYNOTE-811 Investigators. Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastric or gastro-oesophageal junction adenocarcinoma: interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet. 2023 Dec 9;402(10418):2197-2208.?
[18]?Sara Lonardi, et al. 2024 ESMO Abs14000.
[19]?André T, et al. J Clin Oncol. 2023 Jan 10;41(2):255-265.
[20]?Lorenzen S, G?tze TO, Thuss-Patience P, et al.J Clin Oncol, 2024,42(4):410-420
[21]?Khan, K. A., & Kerbel, R. S. (2018).. Nature Reviews Clinical Oncology, 15(5), 310–324.
[22]?Li S, et al. Nat Commun. 2023 Jan 3;14(1):8. doi: 10.1038/s41467-022-35431-x.
[23]?C. Li, Y. Zheng, et al. 2023 ESMO. 1512MO.
- 推荐文章
ESMO 2025现场之声丨彭智教授为您揭幕胃癌领域“里程碑式”研究
“瘤瘤”新知丨酒精与胰腺癌风险关联的新证据:每日多饮10g,风险增加3%!
新药快讯丨卡博替尼首获欧盟批准成为晚期神经内分泌肿瘤“大杀器”
岂有此“例”丨术后5天丧命!局晚期胰腺癌经碳离子放疗后竟发生这种致命并发症?
台湾结直肠癌筛查研究证实FIT筛查手段的重大潜力
ESMO TAT Asia|ADG126联合帕博利珠单抗治疗MSS型肠癌新数据:ORR达29%且安全性可控
晚期胆道癌精准治疗进展如何?看完这篇就懂了
融汇中外,智启未来——中国抗癌协会胃癌专业委员会第19届学术会议在蓉盛大开幕
潘凯枫教授:12年随访研究证实社区人群早期根除幽门螺杆菌或成破解胃癌防控难题的关键突破口丨IGCC 2025
IGCC 2025丨李浙民教授:PD-1/CTLA-4双靶免疫初露锋芒,不同区域学术研究风格尽显
IGCC 2025丨对话大会主席 Henk Hartgrink教授:全球胃癌诊疗困境与破局之路
“瘤瘤”新知丨低剂量放化疗可以改善肛门癌结局?
IGCC 2025丨山东省立医院团队分享8项入选研究成果与参会感悟
IGCC 2025丨国际视野:如何选择晚期胃癌的最佳化疗方案?
IGCC 2025丨国际视野:Bas Wijnhoven教授谈胃癌外科的精准决策与创新实践
苟苗苗教授深度剖析dMMR/MSI-H胃癌治疗进展
IGCC 2025丨陈豪副教授:AI 领航胃癌手术新征程,共探外科精准诊疗全球新趋势
IGCC 2025丨国际视野:ICRGC 项目有望建立胃癌可切除性全球标准
IGCC 2025丨陈凛教授&宁宁教授:中国专场奏响国际舞台,国内胃癌研究与国际接轨
IGCC 2025丨干货满满!聚焦胃癌诊疗创新与国际协作成果——中国专场学术大会圆满落幕IGCC 2025丨干货满满!聚焦胃癌诊疗创新与国际协作成果——中国专场学术大会圆满落幕
DDW 2025热评丨南月敏教授:从分子到临床:TGF-β通路与免疫微环境模型重新定义肝癌早期筛查
IGCC 2025丨闪耀国际舞台!徐泽宽教授率团队亮相IGCC 2025,展现中国胃癌诊疗硬核实力
IGCC 2025丨吴舟桥教授:聚焦IGCC大会,共探胃癌诊疗国际前沿与中青年医生使命
IGCC 2025丨DRAGON-01等三项研究助力攻克胃癌腹膜转移治疗难题
岂有此“例”丨一例11岁儿童早发性结直肠癌伴KRAS突变及多器官转移病例报告
IGCC 2025丨黄华教授:深度解读全球研究格局与中国贡献
IGCC 2025丨中国胃癌诊疗引领全球创新,季加孚教授畅谈国际合作新篇章
ASCO 2025 | 消化系统肿瘤领域重磅研究瞭望聚焦!
天府肿瘤大会丨杨爱明教授: 多学科融合,创新技术推动消化道肿瘤内镜精准诊疗
分会场篇——首届北京抗癌协会胃癌专业委员会年会暨2025年度胃癌前沿进展研讨会圆满召开
IGCC 2025丨梁寒教授:中国原创研究闪耀国际,胃癌诊疗正迎来以综合治疗为核心的新时代
手术演示专场+胃癌青年专家论坛篇——首届北京抗癌协会胃癌专业委员会年会暨2025年度胃癌前沿进展研讨会圆满召开
邓薇教授纵论靶免联合治疗在胃癌围手术期的探索与前景
主会场篇——首届北京抗癌协会胃癌专业委员会年会暨2025年度胃癌前沿进展研讨会圆满召开
现场直击丨2025 IGCC在阿姆斯特丹盛大启幕:共绘胃癌多学科协作新蓝图
“瘤瘤”新知丨患者手术很成功,为何31天内又入院了?
天府肿瘤大会丨邓艳红教授:如何实现肿瘤根治性治疗与器官功能保护“双赢”?
DDW丨早发肠癌日益上升,我们如何见招拆招?
天府肿瘤大会丨李孟鸿教授:肠道微生态蓬勃发展,加快消化道肿瘤新药研发进程
2025 AACR丨关键分子靶点的创新治疗策略
喜报!金晶教授团队多项直肠癌放疗成果闪耀 ESTRO 2025 年会
领航新篇:步召德教授当选北京抗癌协会胃癌专业委员会主任委员,擘画胃癌诊疗规范精准新格局
岂有此“例”丨颠覆认知!C期左肝全累及+门静脉侵犯HCC,手术切除实现6年无复发生存
杨田教授:血清标志物在肝癌诊疗中的临床探索丨CCTB 2025
2025 AACR丨世界舞台上的中国之声
张小田教授:胃癌精准临床研究设计的思考——从指南更迭与推动出海,谈临床智慧推动创新丨CCTB 2025
2025 CSCO指南会丨陈功教授:精准施治,提高转移性肠癌整体治愈率
IGCC前瞻丨中国专家20项口头报告摘要闪耀国际舞台
2025 CSCO指南会丨张小田教授深入解读胃癌诊疗指南更新要点
2025 CSCO指南会丨李健教授:革故鼎新,胃肠间质瘤诊疗指南精要解读与未来展望
CCTB 2025丨破壁立新:沈琳教授谈胃癌诊疗的中国智慧
CCTB 2025丨郭进军教授畅谈消化道肿瘤生物标志物未来蓝图——“创新·转化·合作·共享”
CCTB 2025丨王锡山教授:解锁结直肠癌肿瘤标志物密码,开启精准诊疗新篇章
量体裁衣:帖君教授深度剖析肝癌TACE治疗的争议与临床决策之道
CCTB 2025丨邓艳红教授: “热爱、勇气、合作”——优秀青年PI成长的六字箴言
