- 首页 > 正文
苟苗苗教授深度剖析dMMR/MSI-H胃癌治疗进展
发表时间:2025-07-02 16:13:20
自2015年《新英格兰医学杂志》发表帕博利珠单抗在dMMR实体瘤中的突破性研究,开启了免疫检查点抑制剂(ICIs)治疗MSI-H实体瘤的新篇章。MSI-H/dMMR胃癌作为胃癌的特殊分子亚型,因其独特的生物学行为和显著的免疫治疗敏感性成为焦点。在此背景下,解放军总医院苟苗苗教授围绕“dMMR/MSI-H胃癌治疗进展”,从MSI-H/dMMR胃癌的临床特征、治疗进展以及耐药挑战三个方面,全面梳理了当前的研究成果和未来发展方向,为临床实践提供了宝贵的经验与指导。《肿瘤瞭望消化时讯》特将精彩内容整理如下,以飨读者。
专家简介

苟苗苗 教授
解放军总医院肿瘤内科副主任医师 副教授
日本国立癌研医院 高级访问学者
北京癌症防治学会胃癌防治青年委员会常务委员
北京抗癌协会胃癌专委会常委
CSCO胰腺癌、胆道癌、抗肿瘤药物安全、老年肿瘤防治专委会委员
中国研究型医院学会精准医学与肿瘤MDT专委青年委员、肿瘤外科委员会委员
中国医师协会结直肠肿瘤MDT学组委员、医工融合与智能医学学组委员
中国抗癌协会头颈肿瘤整合康复专委会委员
长期以来从事消化道肿瘤的综合治疗,以第一作者发表15余SCI
多次参与ASCO和ASCO-GI及国内会议交流
CSCO化疗安全管理大赛第一名,个人风采奖
主持一项青年成长课题,参与2项国自然课题和2项重大课题的研究
撰写中国胆管肿瘤多学科综合治疗专家共识、2023人卫出版社《结肠癌肿瘤学》、中国胃癌肝转移诊断与综合治疗中国专家共识(2024版)
独树一帜:MSI-H/dMMR胃癌的临床特征与预后特点
MSI-H/dMMR(微卫星高度不稳定/错配修复缺陷)胃癌是胃癌中一种独特的分子亚型,其发生机制源于DNA错配修复系统的功能缺陷。MMR基因通过编码蛋白形成异源二聚体,负责识别并修复微卫星DNA在复制过程中的错误和损伤。当MMR基因突变导致功能缺陷时,微卫星序列的复制错误无法被纠正,导致微卫星不稳定性(MSI)和高突变负荷(TMB),尤其是移码突变频发。这些突变促使肿瘤产生大量新抗原(MANA),进而激活T细胞免疫应答。然而,肿瘤微环境中的PD-1/PD-L1通路会抑制T细胞功能,重塑“热肿瘤”微环境,这为免疫检查点抑制剂(ICIs)的应用提供了理论依据。
从流行病学特征来看,MSI-H/dMMR胃癌约占全部胃癌病例的6%~8%,具有独特的临床病理学特点。这类肿瘤好发于女性及老年患者,肿瘤多位于胃远端或胃窦部,常表现为溃疡型且多为散发型,与吸烟和饮酒等环境因素无显著相关性。值得注意的是,MSI-H/dMMR胃癌通常表现为较晚的临床分期,但其分子特征与其他常见驱动基因突变(如HER2扩增、BRAF-V600E突变)往往呈现互斥关系。相反,这类肿瘤与PD-L1高表达、肿瘤浸润淋巴细胞(TILs)增多以及高TMB等免疫相关标志物密切相关,且与EBV阳性互斥。
在临床预后方面,MSI-H/dMMR胃癌展现出独特的生物学行为。多项大型临床研究(包括CLASSIC、ARTIST、MAGIC和ITACA-S等)的汇总分析表明,对于可手术切除的病例,MSI-H/dMMR状态与较好的生存预后显著相关,这类患者的生存率显著优于微卫星稳定(MSS)型胃癌。然而有趣的是,在晚期胃癌患者中,MSI-H/dMMR的检出率呈现下降趋势,这一现象可能与该亚型肿瘤在疾病进展过程中独特的生物学行为演变和治疗反应差异有关。这种分期依赖性的分子特征变化提示我们,MSI-H/dMMR胃癌可能存在着复杂的肿瘤微环境动态演变过程,需要在临床治疗决策时予以特别关注。
精准突破:MSI-H/dMMR胃癌的治疗进展
目前,针对MSI-H/dMMR胃癌的治疗策略逐渐从化疗转向免疫治疗,尤其是在围手术期和晚期治疗中。
一、(新)辅助化疗的争议
对于局部进展期MSI-H/dMMR胃癌的(新)辅助化疗,目前仍存在争议。
一项多国、基于个体患者数据的荟萃分析显示(涉及MAGIC、CLASSIC、ARTIST和ITACA-S研究),术后辅助化疗对MSI-H/dMMR患者的生存获益有限,甚至可能缩短无病生存期(DFS)和总生存期(OS)。而后,2020年韩国的一项研究和2021年中国的一项Meta分析则建议行术后辅助治疗。这种分歧可能与研究样本量较小和患者异质性有关。然而,2024年意大利一项包括23项研究的大规模荟萃分析(N=2 161,9.8%为dMMR/MSI)再次指出,新辅助或辅助化疗未能带来显著生存获益。
二、新辅助免疫治疗的突破
随着免疫检查点抑制剂(ICI)的应用,MSI-H/dMMR胃癌的新辅助治疗取得突破性进展。
化疗联合免疫治疗
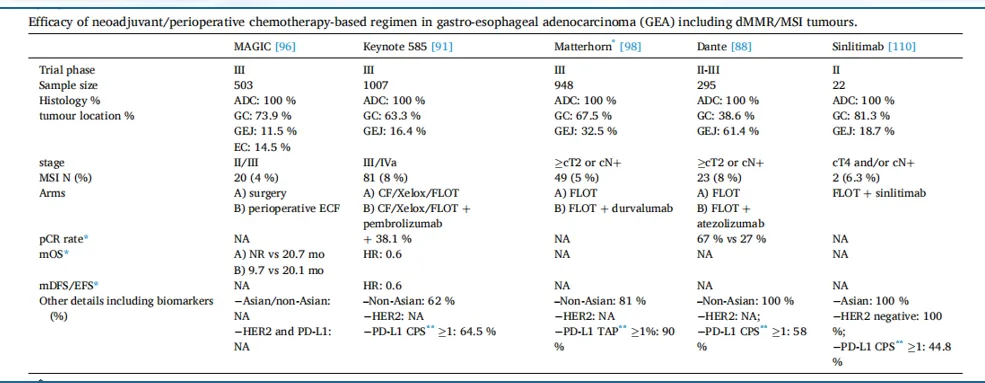
尽管化疗联合免疫治疗尚未成为可切除胃癌的标准治疗,但多项大型临床研究的亚组分析显示,dMMR/MSI患者对化疗联合免疫治疗的响应较为乐观(图1)。例如,KEYNOTE-585研究显示,帕博利珠单抗联合化疗对比单独化疗使dMMR/MSI患者的pCR率达到38.1%,OS提高了40%。同样,DANTE研究亚组分析显示阿替利珠单抗联合化疗也显示出令人鼓舞的pCR率。对此,DANTA研究重新筛选了高免疫应答Biomaker人群继续探索新辅助免疫联合化疗的疗效。
双免治疗
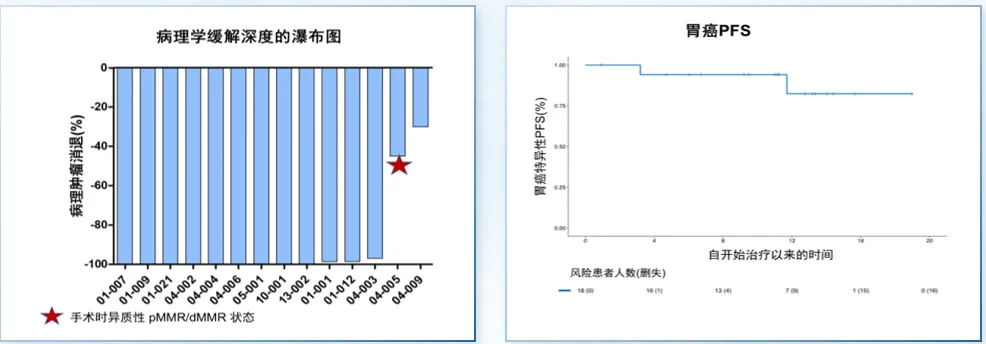
同样,双免治疗策略也显示出良好前景。INFINITY研究旨在探索曲美木单抗联合度伐利尤单抗进行新辅助治疗(组1)以及根治性治疗(组2),在可切除的MSI-H/dMMR胃或胃食管交界部腺癌患者的疗效。研究结果显示,组1中15例患者接受12周新辅助治疗后进行手术,pCR率为60%,主要病理缓解率(MPR)为80%,且整体安全性良好(图2)。然而,T4肿瘤的pCR率显著低于T2~3肿瘤(17% vs. 89%),提示肿瘤分期可能影响疗效。组2正在试验中。
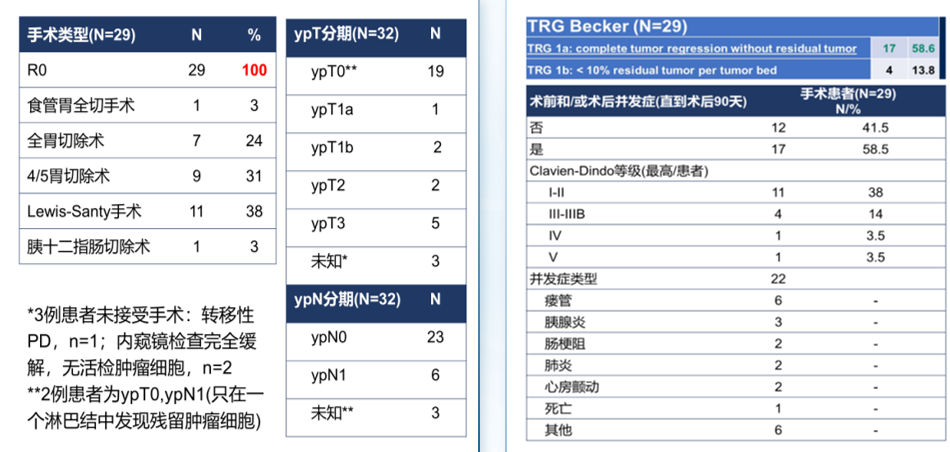
GERCOR NEONIPIGA研究则探索了新辅助纳武利尤单抗联合伊匹木单的治疗模式,结果显示在32例入组患者中,29例接受了根治性手术,pCR率为59%,MPR率为72.4%,且整体安全性可控(图3)。2023年CSCO指南提及此研究,并指出对于dMMR患者的免疫治疗,免疫新辅助和辅助是未来发展趋势。此外,在IMHOTEP研究中,27例患者接受了短期帕博利珠单抗单药治疗,结果显示疗效有限(pCR=11%)。
三、器官保留策略的探索
鉴于胃切除术可能带来显著的术后并发症和生活质量下降,器官保留策略逐渐受到关注。目前有两项Ⅱ期研究正在探索实现临床完全缓解(cCR)患者的非手术治疗(NCT04817826、NCT06059495)。这种方法提出了许多问题,其中之一是如何定义cCR。在同时提到器官保留和主动监测方法的INFINITY(队列2)和SANO临床研究中,所使用的定义结合了多项临床研究外可用的指标。然而,未来如何权衡持续免疫治疗和主动监测的毒性及经济成本与根治性手术的风险,仍需进一步研究。
四、晚期胃癌的治疗进展
对于晚期MSI-H/dMMR胃癌患者,免疫治疗已成为重要选择,但化疗的作用仍存在争议。
一线标准化疗方案(包括FP组合)已显示出有限的有效性。例如,在KEYNOTE-062研究显示中,仅接受化疗的dMMR/MSI患者的中位OS仅为8.5个月。KEYNOTE-059(≥三线治疗)单臂试验以及Ⅲ期KEYNOTE-061(二线治疗)和KEYNOTE-062(一线治疗)随机试验的事后分析发现,虽然化疗(除派姆单抗外)改善了PFS,但对OS无显著影响。
免疫单药治疗
临床研究显示,抗PD-1单药治疗在dMMR/MSI患者中显示出较高的ORR(46.7%~57.1%),而加用化疗后缓解率仅有轻微提升(ORR为64.1%)。在接受ICI治疗的许多患者中观察到长期获益,CheckMate 649研究报告接受化疗联合纳武利尤单抗治疗的患者中位OS为38.7个月。然而,化疗是否能为这一亚组带来显著价值仍存在争议,相关数据稀缺。
免疫联合化疗
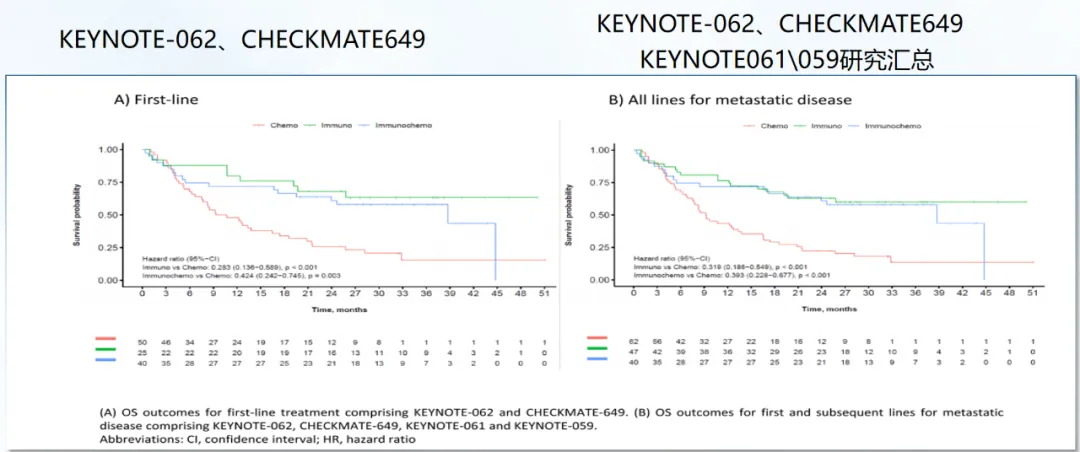
多项研究的OS率汇总分析显示,ICI单药与ICI联合化疗的OS相似(图4)。此外,基于dMMR/MSI肿瘤对ICI的高度敏感性,鼓励在4~6个周期后停止化疗(在具有临床肿瘤反应或低肿瘤负荷的选定病例中),并采用仅ICI维持治疗策略。然而,对于某些亚组,如腹水、骨转移或体能状态差(ECOG-PS≥2)的患者在仅接受ICI治疗时预后较差。
双免联合治疗
无化疗的抗PD-1与抗CTLA-4联合治疗似乎比抗PD-1单药治疗更有效。CheckMate 649研究的MSI-H亚组分析显示,纳武利尤单抗联合伊匹木单抗对比标准化疗,显著延长中位OS,ORR更高。此外,NO LIMIT(WJOG13320G/CA209-7W7)研究初步结果也令人鼓舞。然而,目前dMMR/MSI胃癌中缺乏注册研究,且缺乏抗PD-1单药治疗与抗PD-1联合抗CTLA-4直接比较的数据。尽管如此,一项随机Ⅱ期研究(CIME)正在进行中,以评估PD-1联合CTLA-4抑制剂(botensilimab和baltisilimab)对比标准治疗(FOLFOX联合纳武利尤单抗)在晚期dMMR/MSI胃癌中的疗效。
道阻且长:MSI-H/dMMR胃癌的耐药挑战
尽管免疫治疗为MSI-H/dMMR胃癌患者带来了显著获益,但耐药问题仍是临床面临的重大挑战。
当前研究将耐药机制主要分为原发性和获得性两大类。原发性耐药可能与肿瘤微环境的免疫抑制特性有关,例如抗原呈递途径缺陷、TMB低或T细胞浸润不足(“冷肿瘤”)。此外,TIM-3、LAG-3或VISTA等替代免疫检查点的上调,以及JAK1/2信号通路突变,也可能导致免疫治疗无效。获得性耐药通常表现为治疗初期有效后疾病进展。机制包括新抗原表达丧失、T细胞耗竭或肿瘤微环境的代谢变化。研究发现,PRKDC、KMT2D和KMT2C基因突变可能与免疫治疗反应相关,或可作为预测标志物。
为克服耐药,联合治疗策略成为研究热点。例如,抗PD-1/PD-L1抗体与抗CTLA-4抗体或其他ICI(包括TIGIT、TIM3和LAG-3抑制剂)以及OX40激动剂抗体等联用已显示出协同效应。NICHE-3研究探索了LAG-3抑制剂relatlimab联合纳武利尤单抗在dMMR结肠癌中的疗效,为MSI-H胃癌提供了潜在方向。此外,靶向抗血管生成药物(如阿帕替尼、仑伐替尼)或DNA修复缺陷抑制剂(如针对ARID1A缺陷的药物)等也可能成为逆转耐药的新选择。
总结与展望
MSI-H/dMMR胃癌的诊疗已进入精准免疫治疗时代,其独特的临床特征和分子机制为个体化治疗提供了重要依据。围术期双免联合、晚期一线免疫单药或联合化疗以及器官保留策略等新兴疗法展现出广阔前景。但如何优化联合策略、克服耐药以及实现个体化治疗仍是未来研究的重点。随着更多临床试验的开展和生物标志物的挖掘,MSI-H/dMMR胃癌患者的生存和生活质量有望得到进一步提升,真正实现“精准狙击,长治久安”的治疗目标。
参考文献
1.Bonneville R, et al. JCO Precis Oncol. 2017;2017:PO.17.00073.
1.Elizabeth C Smyth, et al. JAMA Oncol. 2017 Feb.
2.Kim JW, et al. Cancer Res Treat. 2020 Oct;52(4):1178-1187.
3.Nie RC, et al. Ann Surg Oncol. 2022 Apr;29(4):2324-2331.
4.Ghose A, et al. Ther Adv Med Oncol. 2024 Feb 29;16:17588359241233225.
5.Salah-Eddin Al-Batran, et al. 2024 ASCO.
6.de la Fouchardière C, et al. Cancer Treat Rev. 2025 Mar;134:102890.
7.Pavelescu LA, et al. Int J Mol Sci. 2024 Sep 6;25(17):9659.
8.Ooki A, et al. Gastric Cancer. 2024 Sep;27(5):907-931.
专家简介

苟苗苗 教授
解放军总医院肿瘤内科副主任医师 副教授
日本国立癌研医院 高级访问学者
北京癌症防治学会胃癌防治青年委员会常务委员
北京抗癌协会胃癌专委会常委
CSCO胰腺癌、胆道癌、抗肿瘤药物安全、老年肿瘤防治专委会委员
中国研究型医院学会精准医学与肿瘤MDT专委青年委员、肿瘤外科委员会委员
中国医师协会结直肠肿瘤MDT学组委员、医工融合与智能医学学组委员
中国抗癌协会头颈肿瘤整合康复专委会委员
长期以来从事消化道肿瘤的综合治疗,以第一作者发表15余SCI
多次参与ASCO和ASCO-GI及国内会议交流
CSCO化疗安全管理大赛第一名,个人风采奖
主持一项青年成长课题,参与2项国自然课题和2项重大课题的研究
撰写中国胆管肿瘤多学科综合治疗专家共识、2023人卫出版社《结肠癌肿瘤学》、中国胃癌肝转移诊断与综合治疗中国专家共识(2024版)
独树一帜:MSI-H/dMMR胃癌的临床特征与预后特点
MSI-H/dMMR(微卫星高度不稳定/错配修复缺陷)胃癌是胃癌中一种独特的分子亚型,其发生机制源于DNA错配修复系统的功能缺陷。MMR基因通过编码蛋白形成异源二聚体,负责识别并修复微卫星DNA在复制过程中的错误和损伤。当MMR基因突变导致功能缺陷时,微卫星序列的复制错误无法被纠正,导致微卫星不稳定性(MSI)和高突变负荷(TMB),尤其是移码突变频发。这些突变促使肿瘤产生大量新抗原(MANA),进而激活T细胞免疫应答。然而,肿瘤微环境中的PD-1/PD-L1通路会抑制T细胞功能,重塑“热肿瘤”微环境,这为免疫检查点抑制剂(ICIs)的应用提供了理论依据。
从流行病学特征来看,MSI-H/dMMR胃癌约占全部胃癌病例的6%~8%,具有独特的临床病理学特点。这类肿瘤好发于女性及老年患者,肿瘤多位于胃远端或胃窦部,常表现为溃疡型且多为散发型,与吸烟和饮酒等环境因素无显著相关性。值得注意的是,MSI-H/dMMR胃癌通常表现为较晚的临床分期,但其分子特征与其他常见驱动基因突变(如HER2扩增、BRAF-V600E突变)往往呈现互斥关系。相反,这类肿瘤与PD-L1高表达、肿瘤浸润淋巴细胞(TILs)增多以及高TMB等免疫相关标志物密切相关,且与EBV阳性互斥。
在临床预后方面,MSI-H/dMMR胃癌展现出独特的生物学行为。多项大型临床研究(包括CLASSIC、ARTIST、MAGIC和ITACA-S等)的汇总分析表明,对于可手术切除的病例,MSI-H/dMMR状态与较好的生存预后显著相关,这类患者的生存率显著优于微卫星稳定(MSS)型胃癌。然而有趣的是,在晚期胃癌患者中,MSI-H/dMMR的检出率呈现下降趋势,这一现象可能与该亚型肿瘤在疾病进展过程中独特的生物学行为演变和治疗反应差异有关。这种分期依赖性的分子特征变化提示我们,MSI-H/dMMR胃癌可能存在着复杂的肿瘤微环境动态演变过程,需要在临床治疗决策时予以特别关注。
精准突破:MSI-H/dMMR胃癌的治疗进展
目前,针对MSI-H/dMMR胃癌的治疗策略逐渐从化疗转向免疫治疗,尤其是在围手术期和晚期治疗中。
一、(新)辅助化疗的争议
对于局部进展期MSI-H/dMMR胃癌的(新)辅助化疗,目前仍存在争议。
一项多国、基于个体患者数据的荟萃分析显示(涉及MAGIC、CLASSIC、ARTIST和ITACA-S研究),术后辅助化疗对MSI-H/dMMR患者的生存获益有限,甚至可能缩短无病生存期(DFS)和总生存期(OS)。而后,2020年韩国的一项研究和2021年中国的一项Meta分析则建议行术后辅助治疗。这种分歧可能与研究样本量较小和患者异质性有关。然而,2024年意大利一项包括23项研究的大规模荟萃分析(N=2 161,9.8%为dMMR/MSI)再次指出,新辅助或辅助化疗未能带来显著生存获益。
二、新辅助免疫治疗的突破
随着免疫检查点抑制剂(ICI)的应用,MSI-H/dMMR胃癌的新辅助治疗取得突破性进展。
化疗联合免疫治疗
尽管化疗联合免疫治疗尚未成为可切除胃癌的标准治疗,但多项大型临床研究的亚组分析显示,dMMR/MSI患者对化疗联合免疫治疗的响应较为乐观(图1)。例如,KEYNOTE-585研究显示,帕博利珠单抗联合化疗对比单独化疗使dMMR/MSI患者的pCR率达到38.1%,OS提高了40%。同样,DANTE研究亚组分析显示阿替利珠单抗联合化疗也显示出令人鼓舞的pCR率。对此,DANTA研究重新筛选了高免疫应答Biomaker人群继续探索新辅助免疫联合化疗的疗效。

图1. 大型临床研究亚组分析结果
同样,双免治疗策略也显示出良好前景。INFINITY研究旨在探索曲美木单抗联合度伐利尤单抗进行新辅助治疗(组1)以及根治性治疗(组2),在可切除的MSI-H/dMMR胃或胃食管交界部腺癌患者的疗效。研究结果显示,组1中15例患者接受12周新辅助治疗后进行手术,pCR率为60%,主要病理缓解率(MPR)为80%,且整体安全性良好(图2)。然而,T4肿瘤的pCR率显著低于T2~3肿瘤(17% vs. 89%),提示肿瘤分期可能影响疗效。组2正在试验中。

图2. INFINITY研究结果

图3. GERCOR NEONIPIGA研究结果
鉴于胃切除术可能带来显著的术后并发症和生活质量下降,器官保留策略逐渐受到关注。目前有两项Ⅱ期研究正在探索实现临床完全缓解(cCR)患者的非手术治疗(NCT04817826、NCT06059495)。这种方法提出了许多问题,其中之一是如何定义cCR。在同时提到器官保留和主动监测方法的INFINITY(队列2)和SANO临床研究中,所使用的定义结合了多项临床研究外可用的指标。然而,未来如何权衡持续免疫治疗和主动监测的毒性及经济成本与根治性手术的风险,仍需进一步研究。
四、晚期胃癌的治疗进展
对于晚期MSI-H/dMMR胃癌患者,免疫治疗已成为重要选择,但化疗的作用仍存在争议。
一线标准化疗方案(包括FP组合)已显示出有限的有效性。例如,在KEYNOTE-062研究显示中,仅接受化疗的dMMR/MSI患者的中位OS仅为8.5个月。KEYNOTE-059(≥三线治疗)单臂试验以及Ⅲ期KEYNOTE-061(二线治疗)和KEYNOTE-062(一线治疗)随机试验的事后分析发现,虽然化疗(除派姆单抗外)改善了PFS,但对OS无显著影响。
免疫单药治疗
临床研究显示,抗PD-1单药治疗在dMMR/MSI患者中显示出较高的ORR(46.7%~57.1%),而加用化疗后缓解率仅有轻微提升(ORR为64.1%)。在接受ICI治疗的许多患者中观察到长期获益,CheckMate 649研究报告接受化疗联合纳武利尤单抗治疗的患者中位OS为38.7个月。然而,化疗是否能为这一亚组带来显著价值仍存在争议,相关数据稀缺。
免疫联合化疗
多项研究的OS率汇总分析显示,ICI单药与ICI联合化疗的OS相似(图4)。此外,基于dMMR/MSI肿瘤对ICI的高度敏感性,鼓励在4~6个周期后停止化疗(在具有临床肿瘤反应或低肿瘤负荷的选定病例中),并采用仅ICI维持治疗策略。然而,对于某些亚组,如腹水、骨转移或体能状态差(ECOG-PS≥2)的患者在仅接受ICI治疗时预后较差。

图4. 转移性MSI型GEA患者总生存率的汇总分析。(A)一线治疗的OS结局,包括KEYNOTE-062和CHECKMATE-649;(B)转移性疾病一线和二线治疗的OS结局,包括KEYNOTE-062、CHECKMATE-649、KEYNOTE-061和KEYNOTE-05
无化疗的抗PD-1与抗CTLA-4联合治疗似乎比抗PD-1单药治疗更有效。CheckMate 649研究的MSI-H亚组分析显示,纳武利尤单抗联合伊匹木单抗对比标准化疗,显著延长中位OS,ORR更高。此外,NO LIMIT(WJOG13320G/CA209-7W7)研究初步结果也令人鼓舞。然而,目前dMMR/MSI胃癌中缺乏注册研究,且缺乏抗PD-1单药治疗与抗PD-1联合抗CTLA-4直接比较的数据。尽管如此,一项随机Ⅱ期研究(CIME)正在进行中,以评估PD-1联合CTLA-4抑制剂(botensilimab和baltisilimab)对比标准治疗(FOLFOX联合纳武利尤单抗)在晚期dMMR/MSI胃癌中的疗效。
道阻且长:MSI-H/dMMR胃癌的耐药挑战
尽管免疫治疗为MSI-H/dMMR胃癌患者带来了显著获益,但耐药问题仍是临床面临的重大挑战。
当前研究将耐药机制主要分为原发性和获得性两大类。原发性耐药可能与肿瘤微环境的免疫抑制特性有关,例如抗原呈递途径缺陷、TMB低或T细胞浸润不足(“冷肿瘤”)。此外,TIM-3、LAG-3或VISTA等替代免疫检查点的上调,以及JAK1/2信号通路突变,也可能导致免疫治疗无效。获得性耐药通常表现为治疗初期有效后疾病进展。机制包括新抗原表达丧失、T细胞耗竭或肿瘤微环境的代谢变化。研究发现,PRKDC、KMT2D和KMT2C基因突变可能与免疫治疗反应相关,或可作为预测标志物。
为克服耐药,联合治疗策略成为研究热点。例如,抗PD-1/PD-L1抗体与抗CTLA-4抗体或其他ICI(包括TIGIT、TIM3和LAG-3抑制剂)以及OX40激动剂抗体等联用已显示出协同效应。NICHE-3研究探索了LAG-3抑制剂relatlimab联合纳武利尤单抗在dMMR结肠癌中的疗效,为MSI-H胃癌提供了潜在方向。此外,靶向抗血管生成药物(如阿帕替尼、仑伐替尼)或DNA修复缺陷抑制剂(如针对ARID1A缺陷的药物)等也可能成为逆转耐药的新选择。
总结与展望
MSI-H/dMMR胃癌的诊疗已进入精准免疫治疗时代,其独特的临床特征和分子机制为个体化治疗提供了重要依据。围术期双免联合、晚期一线免疫单药或联合化疗以及器官保留策略等新兴疗法展现出广阔前景。但如何优化联合策略、克服耐药以及实现个体化治疗仍是未来研究的重点。随着更多临床试验的开展和生物标志物的挖掘,MSI-H/dMMR胃癌患者的生存和生活质量有望得到进一步提升,真正实现“精准狙击,长治久安”的治疗目标。
参考文献
1.Bonneville R, et al. JCO Precis Oncol. 2017;2017:PO.17.00073.
1.Elizabeth C Smyth, et al. JAMA Oncol. 2017 Feb.
2.Kim JW, et al. Cancer Res Treat. 2020 Oct;52(4):1178-1187.
3.Nie RC, et al. Ann Surg Oncol. 2022 Apr;29(4):2324-2331.
4.Ghose A, et al. Ther Adv Med Oncol. 2024 Feb 29;16:17588359241233225.
5.Salah-Eddin Al-Batran, et al. 2024 ASCO.
6.de la Fouchardière C, et al. Cancer Treat Rev. 2025 Mar;134:102890.
7.Pavelescu LA, et al. Int J Mol Sci. 2024 Sep 6;25(17):9659.
8.Ooki A, et al. Gastric Cancer. 2024 Sep;27(5):907-931.
- 推荐文章
ESMO 2025现场之声丨彭智教授为您揭幕胃癌领域“里程碑式”研究
“瘤瘤”新知丨酒精与胰腺癌风险关联的新证据:每日多饮10g,风险增加3%!
新药快讯丨卡博替尼首获欧盟批准成为晚期神经内分泌肿瘤“大杀器”
岂有此“例”丨术后5天丧命!局晚期胰腺癌经碳离子放疗后竟发生这种致命并发症?
台湾结直肠癌筛查研究证实FIT筛查手段的重大潜力
ESMO TAT Asia|ADG126联合帕博利珠单抗治疗MSS型肠癌新数据:ORR达29%且安全性可控
晚期胆道癌精准治疗进展如何?看完这篇就懂了
融汇中外,智启未来——中国抗癌协会胃癌专业委员会第19届学术会议在蓉盛大开幕
潘凯枫教授:12年随访研究证实社区人群早期根除幽门螺杆菌或成破解胃癌防控难题的关键突破口丨IGCC 2025
IGCC 2025丨李浙民教授:PD-1/CTLA-4双靶免疫初露锋芒,不同区域学术研究风格尽显
IGCC 2025丨对话大会主席 Henk Hartgrink教授:全球胃癌诊疗困境与破局之路
“瘤瘤”新知丨低剂量放化疗可以改善肛门癌结局?
IGCC 2025丨山东省立医院团队分享8项入选研究成果与参会感悟
IGCC 2025丨国际视野:如何选择晚期胃癌的最佳化疗方案?
IGCC 2025丨国际视野:Bas Wijnhoven教授谈胃癌外科的精准决策与创新实践
苟苗苗教授深度剖析dMMR/MSI-H胃癌治疗进展
IGCC 2025丨陈豪副教授:AI 领航胃癌手术新征程,共探外科精准诊疗全球新趋势
IGCC 2025丨国际视野:ICRGC 项目有望建立胃癌可切除性全球标准
IGCC 2025丨陈凛教授&宁宁教授:中国专场奏响国际舞台,国内胃癌研究与国际接轨
IGCC 2025丨干货满满!聚焦胃癌诊疗创新与国际协作成果——中国专场学术大会圆满落幕IGCC 2025丨干货满满!聚焦胃癌诊疗创新与国际协作成果——中国专场学术大会圆满落幕
DDW 2025热评丨南月敏教授:从分子到临床:TGF-β通路与免疫微环境模型重新定义肝癌早期筛查
IGCC 2025丨闪耀国际舞台!徐泽宽教授率团队亮相IGCC 2025,展现中国胃癌诊疗硬核实力
IGCC 2025丨吴舟桥教授:聚焦IGCC大会,共探胃癌诊疗国际前沿与中青年医生使命
IGCC 2025丨DRAGON-01等三项研究助力攻克胃癌腹膜转移治疗难题
岂有此“例”丨一例11岁儿童早发性结直肠癌伴KRAS突变及多器官转移病例报告
IGCC 2025丨黄华教授:深度解读全球研究格局与中国贡献
IGCC 2025丨中国胃癌诊疗引领全球创新,季加孚教授畅谈国际合作新篇章
ASCO 2025 | 消化系统肿瘤领域重磅研究瞭望聚焦!
天府肿瘤大会丨杨爱明教授: 多学科融合,创新技术推动消化道肿瘤内镜精准诊疗
分会场篇——首届北京抗癌协会胃癌专业委员会年会暨2025年度胃癌前沿进展研讨会圆满召开
IGCC 2025丨梁寒教授:中国原创研究闪耀国际,胃癌诊疗正迎来以综合治疗为核心的新时代
手术演示专场+胃癌青年专家论坛篇——首届北京抗癌协会胃癌专业委员会年会暨2025年度胃癌前沿进展研讨会圆满召开
邓薇教授纵论靶免联合治疗在胃癌围手术期的探索与前景
主会场篇——首届北京抗癌协会胃癌专业委员会年会暨2025年度胃癌前沿进展研讨会圆满召开
现场直击丨2025 IGCC在阿姆斯特丹盛大启幕:共绘胃癌多学科协作新蓝图
“瘤瘤”新知丨患者手术很成功,为何31天内又入院了?
天府肿瘤大会丨邓艳红教授:如何实现肿瘤根治性治疗与器官功能保护“双赢”?
DDW丨早发肠癌日益上升,我们如何见招拆招?
天府肿瘤大会丨李孟鸿教授:肠道微生态蓬勃发展,加快消化道肿瘤新药研发进程
2025 AACR丨关键分子靶点的创新治疗策略
喜报!金晶教授团队多项直肠癌放疗成果闪耀 ESTRO 2025 年会
领航新篇:步召德教授当选北京抗癌协会胃癌专业委员会主任委员,擘画胃癌诊疗规范精准新格局
岂有此“例”丨颠覆认知!C期左肝全累及+门静脉侵犯HCC,手术切除实现6年无复发生存
杨田教授:血清标志物在肝癌诊疗中的临床探索丨CCTB 2025
2025 AACR丨世界舞台上的中国之声
张小田教授:胃癌精准临床研究设计的思考——从指南更迭与推动出海,谈临床智慧推动创新丨CCTB 2025
2025 CSCO指南会丨陈功教授:精准施治,提高转移性肠癌整体治愈率
IGCC前瞻丨中国专家20项口头报告摘要闪耀国际舞台
2025 CSCO指南会丨张小田教授深入解读胃癌诊疗指南更新要点
2025 CSCO指南会丨李健教授:革故鼎新,胃肠间质瘤诊疗指南精要解读与未来展望
CCTB 2025丨破壁立新:沈琳教授谈胃癌诊疗的中国智慧
CCTB 2025丨郭进军教授畅谈消化道肿瘤生物标志物未来蓝图——“创新·转化·合作·共享”
CCTB 2025丨王锡山教授:解锁结直肠癌肿瘤标志物密码,开启精准诊疗新篇章
量体裁衣:帖君教授深度剖析肝癌TACE治疗的争议与临床决策之道
CCTB 2025丨邓艳红教授: “热爱、勇气、合作”——优秀青年PI成长的六字箴言
