- 首页 > 正文
CCTB 2025丨王锡山教授:解锁结直肠癌肿瘤标志物密码,开启精准诊疗新篇章
发表时间:2025-06-25 16:20:44
在肿瘤领域,结直肠癌(CRC)严重威胁人类健康。2022年数据显示,中国结直肠癌新发病例及死亡病例分别占据全部恶性肿瘤发病率和死亡率的第二、四位,防治形势严峻。肿瘤标志物作为CRC诊疗过程中的关键工具,近年来备受关注。
2025年4月11~13日,2025年CACA肿瘤标志物学术大会暨肿瘤标志物产业创新大会暨肿瘤标志物青年科学家大会暨整合肿瘤学学术会议在重庆召开。中国医学科学院肿瘤医院的王锡山教授就结直肠癌肿瘤标志物的研究进展与临床价值展开深入讲解,为相关领域的研究和临床实践提供了宝贵见解。

王锡山教授
主任医师、博士生导师
中国医学科学院/北京协和医学院长聘教授
现任中国医师协会结直肠肿瘤专业委员会主任委员、中国抗癌协会大肠癌专业委员会主任委员、中国抗癌协会大肠癌专业委员会青年委员会主任委员、中国医师协会结直肠肿瘤专业委员会经自然腔道取标本手术(NOSES)专业委员会主任委员、中国医师协会常务理事、中国抗癌协会整合肿瘤学分会副主任委员、中国医师协会外科医师分会常务委员、北京整合医学学会副会长、北京肿瘤学会常务理事、北京肿瘤学会结直肠肿瘤专业委员会主任委员、俄罗斯结直肠外科协会荣誉委员、国际NOSES联盟主席、中国NOSES联盟主席。创办并担任《中华结直肠疾病电子杂志》主编,担任《中国肿瘤临床与康复杂志》副主编、《中华胃肠外科杂志》《中国实用外科杂志》《中华实验外科杂志》《肿瘤研究与临床》等十余种杂志的编委。
一、结直肠癌肿瘤标志物发展历程
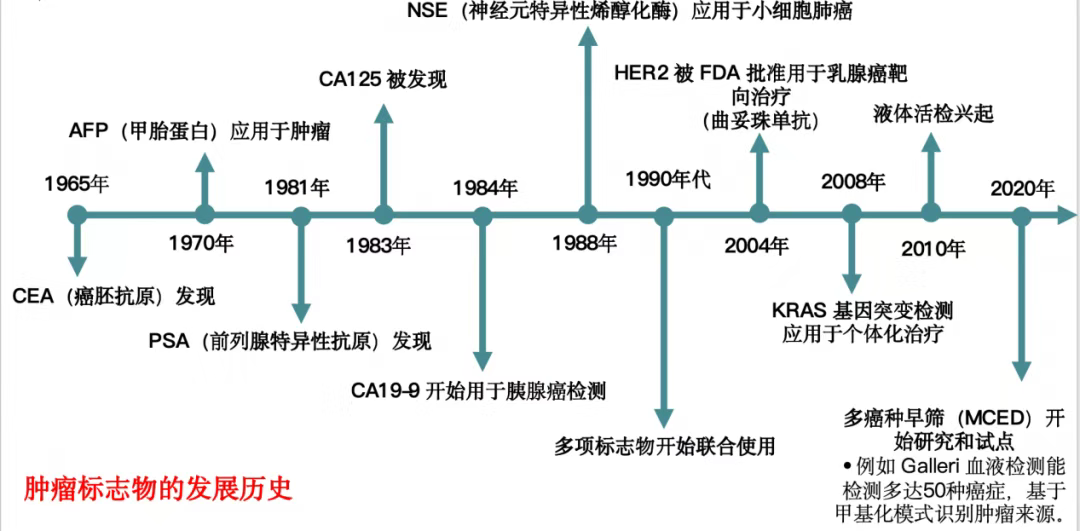
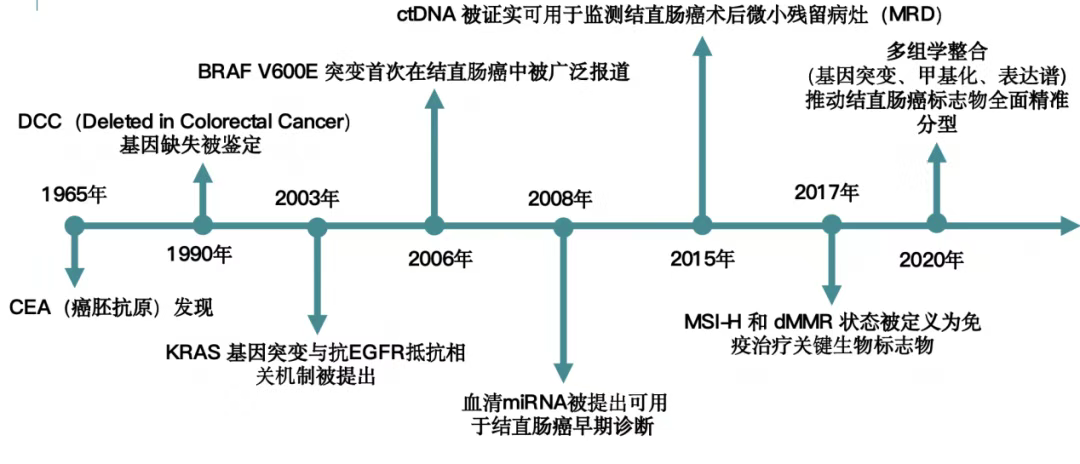
肿瘤标志物的发现与应用历经漫长进程。1965年癌胚抗原(CEA)的发现,开启了肿瘤标志物研究的大门。此后,多种标志物相继问世,如1970年应用于肿瘤检测的甲胎蛋白(AFP)、1981年发现的前列腺特异性抗原(PSA)等(图1)。在结直肠癌领域,肿瘤标志物也有独特发展轨迹(图2)。
二、肿瘤标志物的类型与检测方法
(一)肿瘤标志物的类型
肿瘤标志物分为体液标志物和粪便标志物[1]。体液标志物中,基因类如KRAS、NRAS等在肿瘤发生发展中起关键作用,40%~50%的结直肠癌患者存在KRAS点突变。RNA类的lncRNA、miRNA和circRNA等也参与其中,部分lncRNA表达失调会刺激癌细胞增殖。蛋白类的CEA、CA199等是常用标志物,CEA在Ⅰ~Ⅳ期结直肠癌患者中的阳性率不同。粪便标志物包含DNA相关标志物、miRNA类以及微生物组标志物等,具有无创优势。
(二)检测方法
常用检测方法各有优劣。免疫组织化学(IHC)操作简单、费用低,用于检测蛋白表达,但无法反映基因变异。荧光原位杂交技术(FISH)检测基因扩增等情况。基因检测中的Sanger测序法、荧光定量PCR应用较多,但只能检测特定范围突变。第二代测序(NGS)可同时检测多个基因甚至全基因组变异。
三、肿瘤标志物的临床价值
(一)诊断价值
肿瘤标志物在结直肠癌的诊断中具有重要意义,但也存在一定的局限性。CEA、CA199和CA242诊断结直肠癌的敏感度分别为52%、35%和46%。在早期结直肠癌患者中,CA199(Ⅰ期15%,Ⅱ期34%)和CA242(Ⅰ期17%,Ⅱ期30%)的阳性率较低[2]。有相关研究尝试将CEA和CA19-9等传统标志物联合检测,虽在一定程度上可提高诊断准确性,但仍难以满足临床早期筛查的需求。为了弥补传统标志物的不足,新的标志物不断被探索。例如DNA甲基化,分为从头甲基化和保留甲基化两种类型,目前临床应用DNA甲基化筛查结直肠癌主要采用粪便标本和PCR检测方法。常见的甲基化基因如多配体蛋白聚糖(SDC2),其筛查灵敏性为86.67%,特异性为96.67%[3]。
miRNA也是研究热点之一,其种类丰富,但不同指标对CRC的诊断特异性和敏感性存在较大差异,多个研究表明联用多种miRNA在结直肠癌的早期诊断更具优势。外泌体作为一种新型标志物,广泛存在于各类体液中,携带与肿瘤细胞相似的遗传信息,其包含的外泌体miRNAs、外泌体LncRNAs和外泌体circRNAs在结直肠癌的诊断及预后判断中均有重要意义,但外泌体异质性显著,需要建立更先进的检测技术[4]。circRNA在CRC发病过程中部分表达升高,有望成为诊断指标[5],但仍需更多研究来明确其与结直肠癌发生发展的关系(图3)。
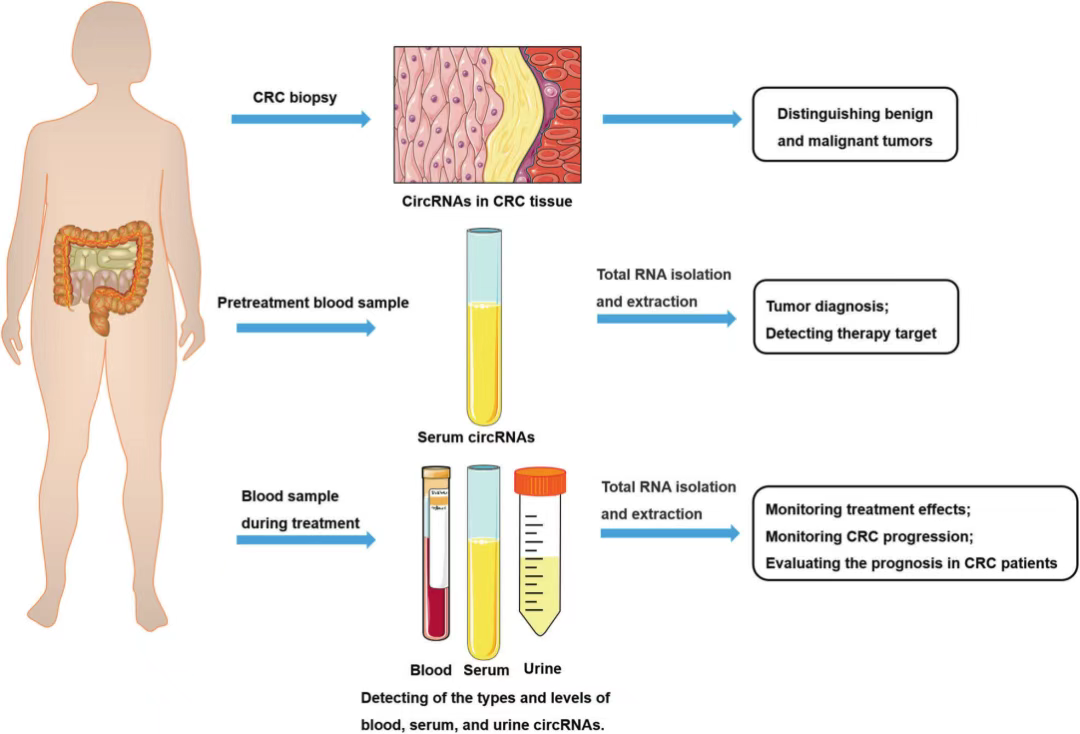
(二)预测价值
1.肠道菌群与ctDNA:肠道菌群作为维持肠道微生态系统稳定的重要组成部分,与结直肠癌的发生发展密切相关。人类肠道菌群基因数量众多,参与人体多种生理过程。其改变对CRC的发生发展具有提示作用,如促进肿瘤细胞恶性转化、驱动肿瘤细胞侵袭和迁移以及影响肿瘤微环境等[6]。然而,目前缺乏大样本研究数据支持,具体机制也尚不完全清楚,其临床应用仍有待进一步探索。循环肿瘤DNA(ctDNA)的出现为肿瘤治疗监测和全程管理带来了新的契机。它可用于MRD检测和辅助治疗疗效监测、预测局部晚期结直肠癌复发及转移、进行分子复发监测、肿瘤分型、评估早期治疗应答以及识别靶向治疗耐药并寻找治疗时机等。
一项由中国医学科学院肿瘤医院牵头的多中心前瞻性临床试验(Protector-CStudy),对基于外周血多基因甲基化标志物在肠癌术后复发监控中的应用进行研究。初步结果显示,ctDNA在术前阳性率及术后第1个月阳性率均较CEA高,术后1个月评估MRD,HR(风险比)为8.0,ctDNA+复发率为21.1%,ctDNA-复发率为2.6%,术后第1个月ctDNA检测的灵敏性和特异性分别是65.9%和83.5%,阳性预测值为21.2%,阴性预测值为97.2%。这表明ctDNA在结直肠癌术后复发监测方面具有一定的价值,但该研究也指出,目前的复发率6.9%可能低于既往数据,这可能与随访时间尚短及Ⅰ-Ⅱ期患者占比过半有关,随着术后时间延长,复发人数和复发比率可能会增加。
2.CTC与肿瘤分期及检测应用:循环肿瘤细胞(CTC)是从肿瘤病灶进入血液的肿瘤细胞。2010年,美国癌症联合委员会AJCC将CTC列入TNM分期系统的cM0(i+)分期,用于更精准评估肿瘤远端转移。CTC检测在结直肠癌诊疗中应用广泛,可辅助诊断、评估疗效、检测MRD、指导用药和监测复发。无细胞DNA(cfDNA)是细胞坏死或凋亡后释放入血的DNA片段,ctDNA是肿瘤来源的cfDNA,虽占比仅0.001%~1%,但半衰期短,能及时反映肿瘤负荷变化,在肿瘤诊疗中具有重要参考价值。
(三)疗效评估与指导用药价值
1.MSI与MMR:微卫星不稳定(MSI)状态和错配修复(MMR)蛋白表达是评估免疫检查点抑制剂疗效的重要预测指标。一般来说,dMMR相当于MSI-H,pMMR相当于MSI-L或MSS。MSI-H状态的Ⅱ期和Ⅲ期结直肠癌患者预后通常优于MSS患者,且MSI-H的Ⅱ期患者一般不能从氟尿嘧啶(5-FU)类单药化疗中获益,因此建议Ⅱ期患者术后常规进行MSI检测,以便为后续治疗方案的选择提供依据。
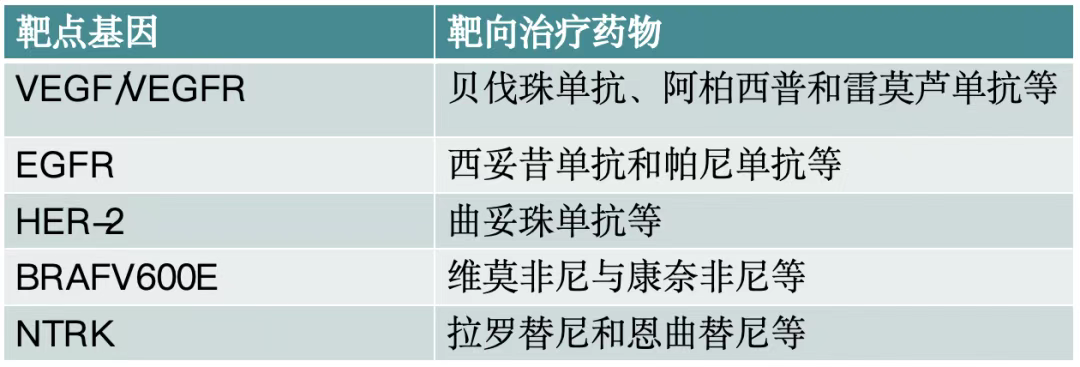
2.遗传易感基因与靶向药物:遗传易感性基因如APC、MMR和STK-11等与结直肠癌的发生发展密切相关。APC突变与家族性腺瘤性息肉病有关,MLH1、MSH2、MSH6和PMS2是最常发生突变的4个MMR基因。NTRK基因融合在结直肠癌中发生率极低,小于1%。PIK3CA突变可与RAS突变共同存在。针对不同的靶点基因,有多种靶向治疗药物,如针对VEGF/VEGFR的贝伐珠单抗、阿柏西普和雷莫芦单抗等;针对EGFR的西妥昔单抗和帕尼单抗等[7](表1)。
表1. 常用靶向药物
(四)预后判定价值
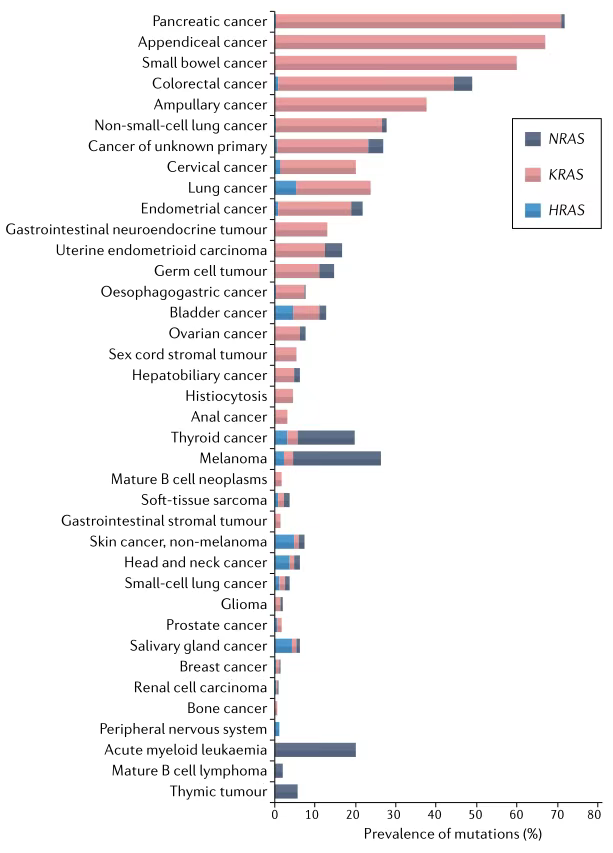
1.KRAS、NRAS和BRAF基因:KRAS和NRAS基因编码的GTP酶蛋白参与EGFR的信号转达,调控细胞生长等过程。40%~50%的结直肠癌患者存在KRAS点突变,3.8%的患者存在NRAS基因点突变(图4)。RAS野生型的晚期结直肠癌患者能从抗EGFR单抗治疗中获益,尤其是左半结肠和直肠癌患者,总生存时间可显著延长;而RAS基因突变患者一般采用化疗联合VEGF单抗治疗[8]。
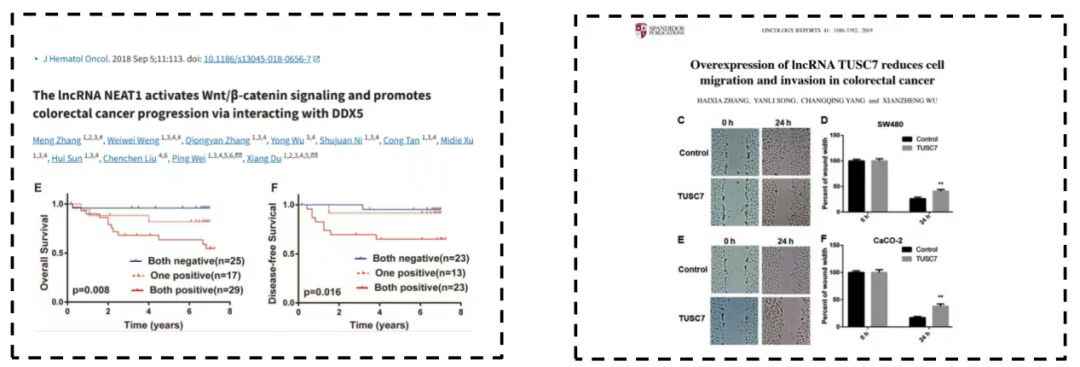
3.LncRNA:LncRNA与结直肠癌的发生发展有关,其表达失调可刺激结直肠癌细胞增殖、促进生长并降低预后。例如LncRNA TUSC7可通过ZEB1抑制大肠癌的EMT,从而抑制其转移能力(图6)。但LncRNA与结直肠癌的生物分子机制仍有待进一步深入研究。
(一)案例1
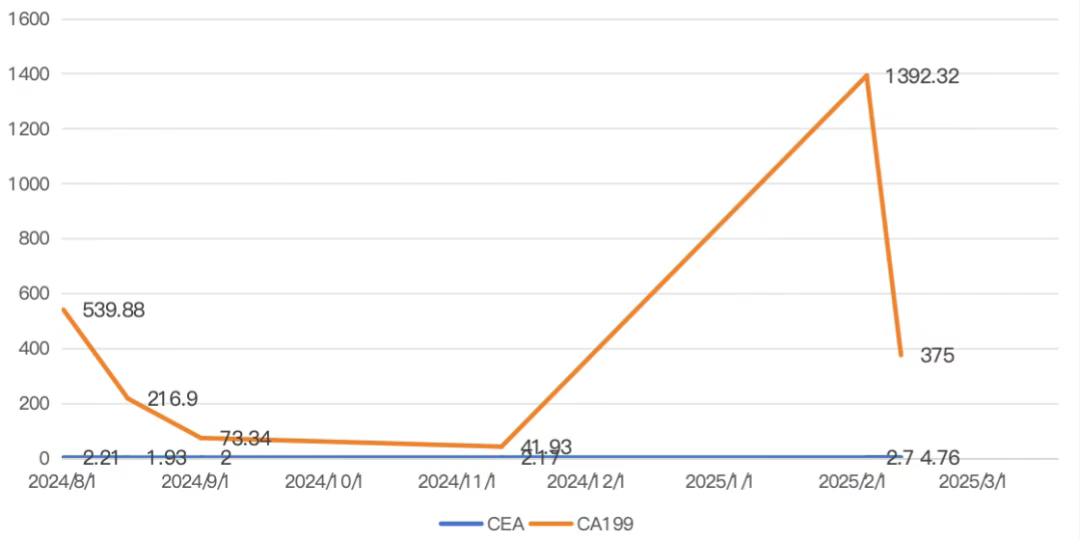
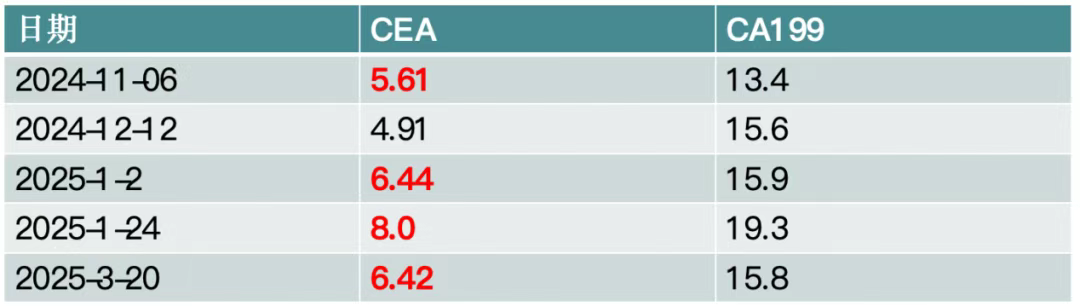
患者为51岁男性,外院结肠癌+肝转移术后9月余,出现腹痛症状。术后进行规律的肿瘤标志物监测,发现CA199持续高于正常范围,而CEA持续正常(图7)。期间常规增强CT未明确转移情况,但完善PETCT/MRI后考虑复发转移。最终通过手术及病理确诊为吻合口中分化腺癌浸润,多处出现转移,pTNM分期为rypT4bN1bM1(图8)。此案例表明,肿瘤标志物升高可能早于常规影像学检查发现肿瘤复发转移,对肿瘤的监测具有重要提示作用。
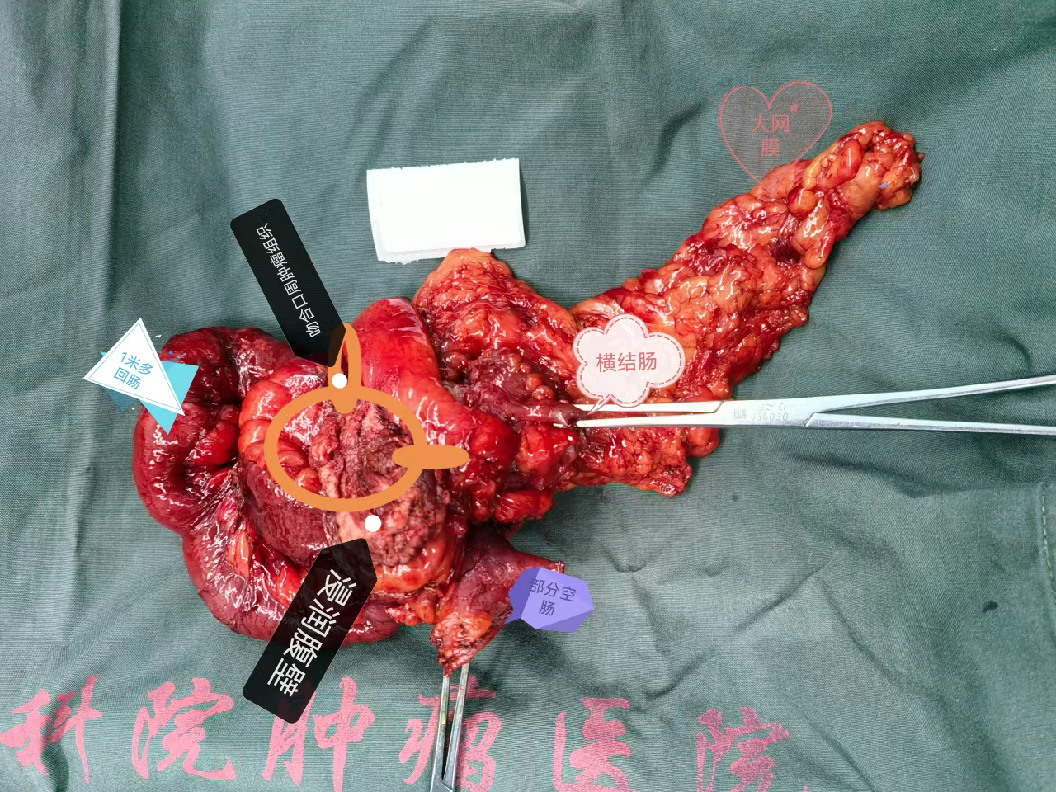
(二)案例2
56岁女性,确诊结肠癌1年,经过多周期化疗。新辅助化疗前CEA为阳性,化疗开始至术前转为阴性,但肿瘤仍然存在(图9)。术后病理显示结肠隆起型中-低分化腺癌,肿瘤侵透结肠浆膜累及多处组织,pTNM分期为ypT4bN0(图10)。该案例说明新辅助化疗后肿瘤标志物可能恢复正常,但并不代表肿瘤已完全消除,临床医生不能仅依据肿瘤标志物的变化来判断肿瘤的实际情况。
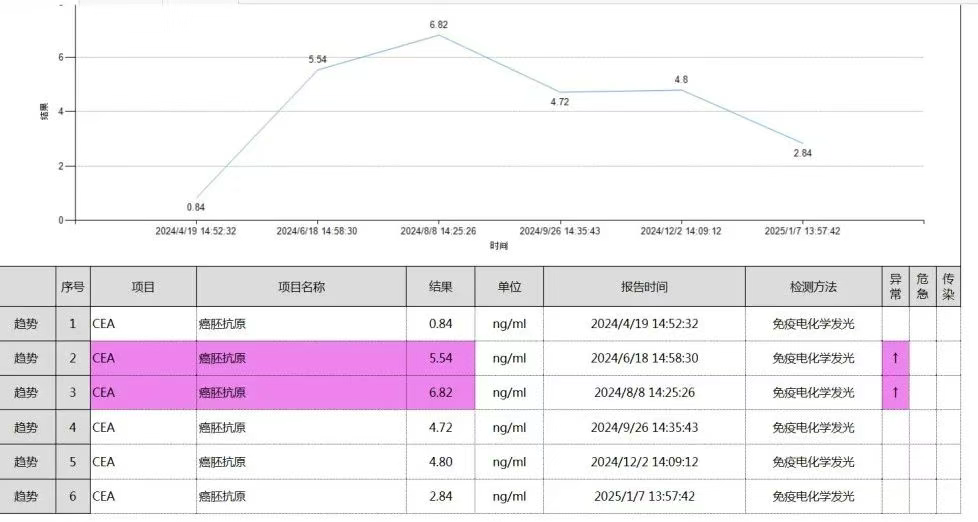
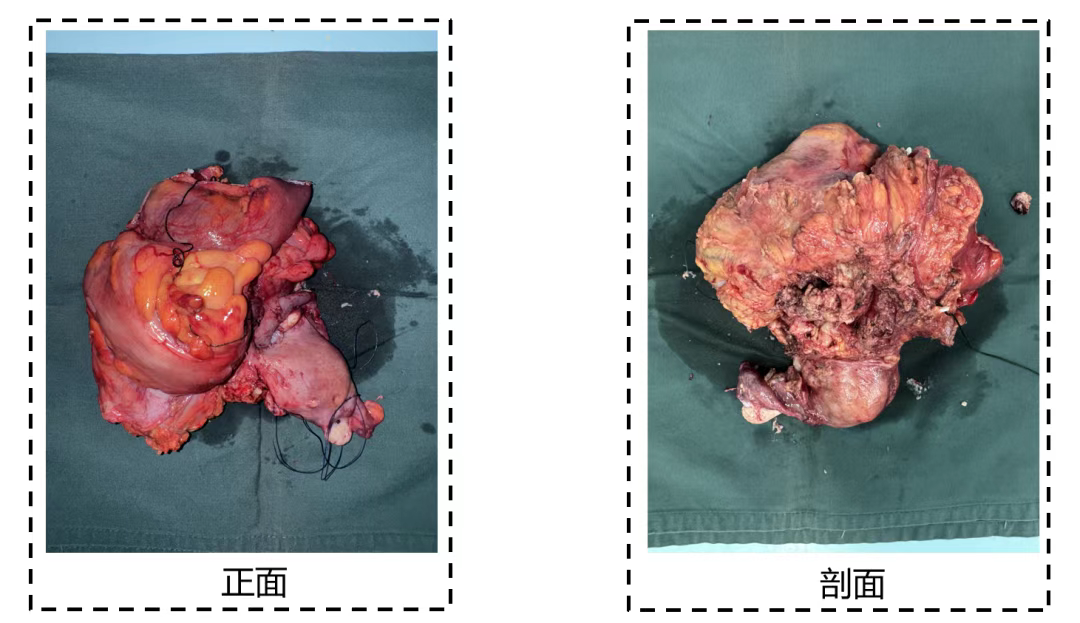
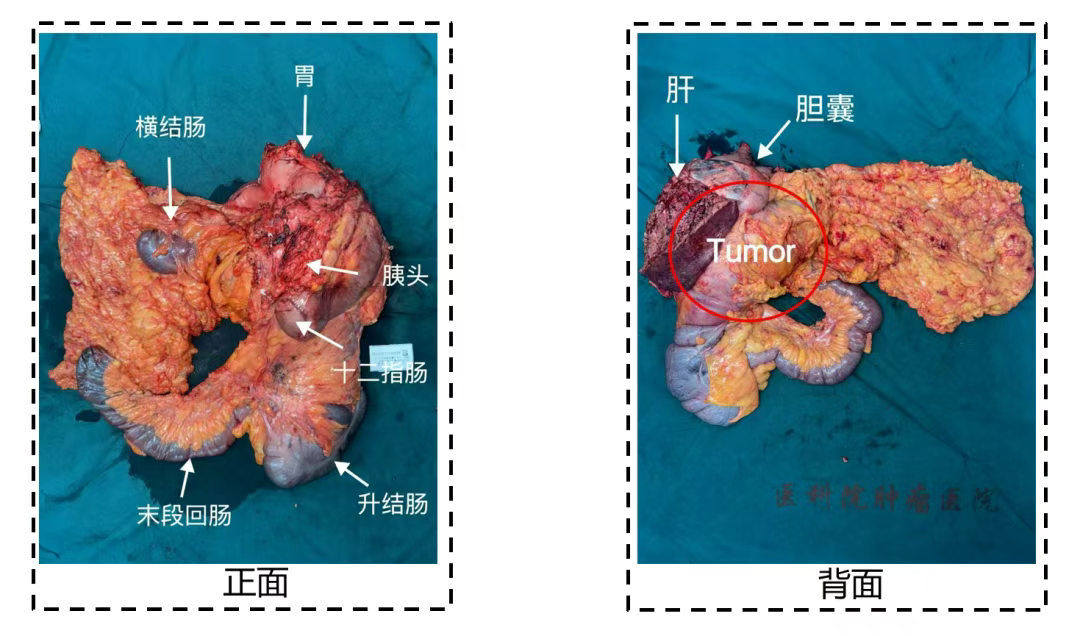
(三)案例3
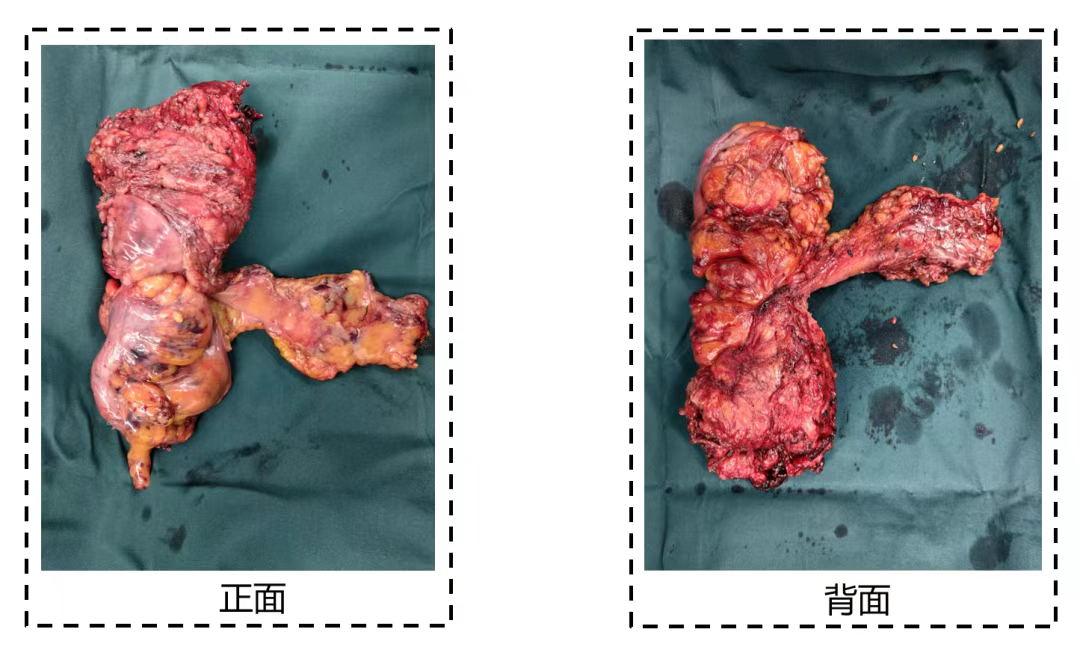
57岁男性,因间断腹痛及消瘦就医,检查发现结肠恶性肿瘤并侵犯肝脏及十二指肠。术前肿瘤标志物CEA、CA199及CA724均升高,术后复查这些标志物均恢复正常(图11)。术后病理为结肠中分化腺癌,肿瘤侵透浆膜累及多个器官(图12),pTNM分期为ypT4bN0。此案例显示手术切除肿瘤后,肿瘤标志物通常会恢复正常,可作为评估手术疗效的一个参考指标。

(四)案例4
43岁男性,大便带血9月余,诊断为直肠粘液腺癌(图13)。在治疗过程中,CEA较正常值略高且变化不明显,无法有效反映辅助化疗效果(表2)。该案例提示部分肿瘤标志物在评估辅助化疗效果时可能存在局限性,临床医生需要综合多种因素进行判断。
五、结直肠癌肿瘤标志物研究的意义与展望
截至2019年,中国结直肠癌患者现存病例约350余万例,这些患者对监测肿瘤是否进展或复发转移的需求极为迫切,这也凸显了继续开发相关肿瘤标志物的重要性。虽然目前肿瘤标志物在临床应用中还存在一些问题,如传统标志物特异性不足、部分新标志物研究尚处于探索阶段等,但随着研究的不断深入,其巨大的研究开发潜力有望得到充分挖掘,从而为结直肠癌患者带来更精准的诊断、更有效的治疗方案,造福广大患者和社会。
参考文献
[1]中华医学会肿瘤学分会早诊早治学组.中国结直肠癌早诊早治专家共识(2023版)[J].中华普通外科学文献电子版, 2024, 18(01):1-13.DOI:10.3877/cma.j.issn.1674-0793.2024.01.001.
[2]Shenghuai Hou, etal. Altern Ther Health Med. 2023 Sep;29(6):192 - 197.
[3]Hao K, et al. LncRNA - Safe contributes to cardiac fibrosis through Safe - Sfpz - Huk complex in mouse myocardial infarction[J]. Theranostics, 2019, 9(24): 7282 - 7297.
[4]Chang Y, et al. Exosomal Components and Modulators in Colorectal Cancer: Novel Diagnosis and Prognosis Biomarkers[J]. biomedicines, 2021 Jul 31;9(8):931.
[5]Zhang Y, et al. CircRNAs in colorectal cancer: potential biomarkers and therapeutic targets[J]. Cell Death Dis. 2023 Jun 9;14(6):333.
[6]Zheng Z, et al. Gut microbiota and colorectal cancer metastasis. Cancer Lett. 2023.
[7]中国医师协会结直肠肿瘤专业委员会, 中国抗癌协会大肠癌专业委员会, 国家癌症中心国家肿瘤质控中心结直肠癌质控专家委员会. 结直肠癌靶向治疗中国专家共识[J/OL]. 中华结直肠疾病电子杂志, 2022, 11(05): 353-360.
[8]Punekar, S.R., et al. The current state of the art and future trends in RAS - targeted cancer therapies. Nat Rev Clin Oncol 19, 637 - 653 (2022)
[9]Wang F, et al. Evaluation of POLE and POLD1 Mutations as Biomarkers for Immunotherapy Outcomes Across Multiple Cancer Types[J]. JAMA oncology, 2019
- 推荐文章
