- 首页 > 正文
岂有此“例”丨陈颖教授:一例初治结肠癌多发肝转移患者2次达到NED的病例分享
肿瘤瞭望消化时讯 发表时间:2025-01-16 14:55:15
编者按:肝脏是结直肠癌血行转移最主要的靶器官,结直肠癌肝转移是结直肠癌治疗的重点和难点之一。有15%~25%结直肠癌患者在确诊时即合并有肝转移,而另15%~25%的患者将在结直肠癌原发灶根治术后发生肝转移,其中绝大多数(80%~90%)的肝转移灶初始无法获得根治性切除。肝转移也是结直肠癌患者最主要的死亡原因。

病例再现
1.患者信息
患者,女性,59岁,ECOG 1分。
2021年4月20日体检行腹部超声提示肝内低回声结节。
4月27日于外院行肝脏增强MRI,显示肝脏多发转移瘤(图1),较大者约2.7×3.1×2.8 cm。
5月8日在外院行肠镜检查,显示乙状结肠距肛18~20 cm见一隆起型肿物,占管腔1/3周,周围黏膜呈结节状环堤隆起,质地脆,触之易出血。
肠镜病理显示为乙状结肠腺癌。
免疫组化:HER-2(0),MLH1(+),MSH2(+)。MSH6(+),PMS2(+)。多基因检测显示KRAS第2外显子错义突变,未检测到MSH-H,PD-L1表达CPS阳性,CPS≥1(CPS=2),TPS<1%。
临床诊断为乙状结肠腺癌T4N+M1,IV期,肝脏见7个病灶,CEA>1000 ng/ml,CRS评分4分,高危险分层。
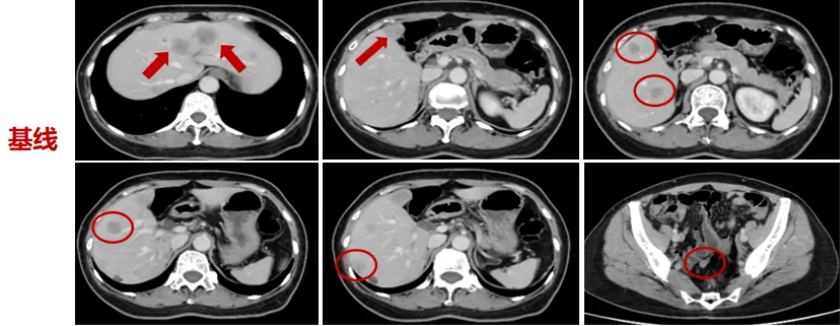
图1. 患者初始影像学检查(2021年4月27日)图像
(1)一线治疗
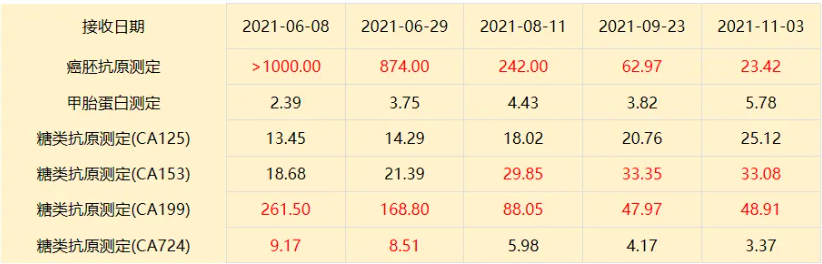
- 2021年5月12日,给予患者Capox+贝伐珠单抗治疗2周期后,肝转移灶即明显缩小(图2),疗效达PR,肿瘤标志物较基线时明显下降(表1)。
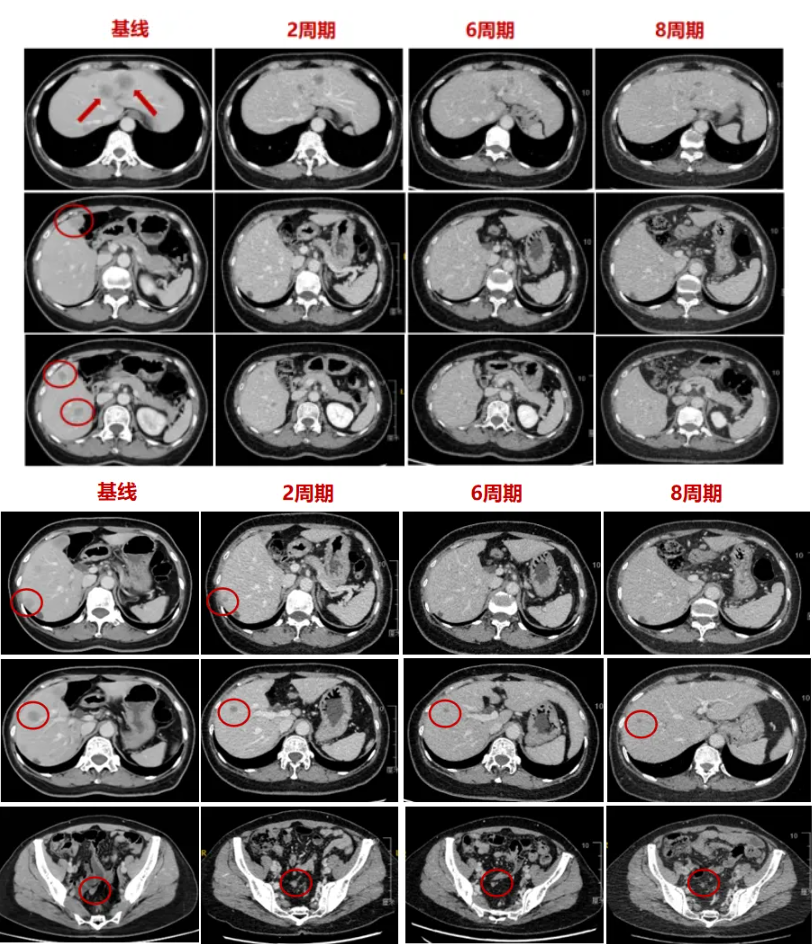
图2. 患者一线治疗后(2021年5月21日)的影像学检查图像
表1. 患者肿瘤标志物检查数据
- 多学科MDT会诊
(2)手术治疗
12月21日,该患者在外院行肠镜进肛门20 cm见2 cm溃疡,周围黏膜结节样隆起,纳米碳黏膜下肽夹一枚定位,次日于外院行直肠Dixon+肝部分切除+RFA。
术后于2022年1月再次给予Capox治疗1周期,后续给予单药卡培他滨维持性化疗。
2022年3月30日患者来笔者医院复查,检查结果显示肿瘤标志物正常,腹部增强CT及肝脏增强MRI未示见异常(图3)。
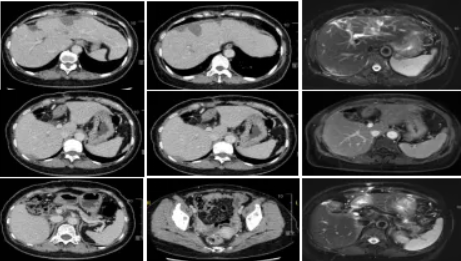
图3. 2022年3月30日影像学检查
- 停药随访
- 肝脏出现新发转移灶
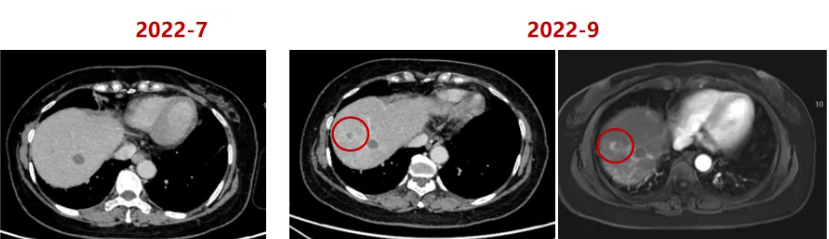
图4. 2022年9月复发影像学图像
(3)二线治疗
2022年9月起开始予以mXELIRI+贝伐珠单抗二线治疗,期间因疫情原因于外院规律治疗。
2023年1月4日于北京行介入治疗,肝S8肿瘤消融1次,肝动脉栓塞两次,灌注三次(奥沙利铂+5FU)。
2023年3月外院复查影像学提示肝脏病灶达CR,但CEA仍高达41 ng/nl。
(4)三线治疗
2023年5月该患者于外院前后肝部消融确诊2个肿瘤+3个疑似肿瘤,经过5次介入+5次灌注化疗(奥沙利铂+5FU)+2次静滴贝伐珠单抗,CEA降至5.44 ng/ml。此时患者因体力不佳,未再进一步行抗肿瘤治疗。
后续患者定期复查,截至目前患者体力较前恢复,2024年9月28日复查暂无复发转移征象,CEA、CA125、CA199均在正常范围内,MRD结果暂未回示。

陈颖 教授
中国医科大学附属第一医院
肿瘤内科,医学博士,主治医师
CSCO青年专家委员会 常委
中国老年医学会肿瘤康复分会委员
辽宁省细胞生物学学会遗传性肿瘤学会理事
辽宁省细胞生物学学会肿瘤营养学会理事
辽宁省细胞生物学会肿瘤精准医疗与大数据管理专业委员会委员
辽宁省腹部肿瘤委员会委员
北京癌症防治学会胃癌防治专业委员会委员
北京医学奖励基金会肺癌青年专家委员
主持辽宁省科技厅课题1项
病例小结与思考
- 推荐文章
