- 首页 > 正文
岂有此“例”丨胰十二指肠切除术后机器人辅助肝切除术安全实践——三例超晚期肝转移瘤微创治疗经验与筛选策略
发表时间:2026-02-07 21:33:04
编者按
胰十二指肠切除术(PD)作为上腹部复杂的手术之一,术后广泛粘连与解剖重构常使二次肝切除面临"禁区"挑战。本期《岂有此"例"》聚焦东京医科大学团队创新实践——三例PD术后肝转移患者成功实施机器人辅助肝切除术(RAH)的突破性案例,为这一临床难题提供了珍贵经验。本期病例集以详实的手术细节、创新的围术期管理策略及严谨的循证分析,为肝胆外科医生挑战"手术禁区"提供了可复制的实践范本,值得深入研读与临床借鉴。
病例介绍
1.手术技术与围手术期管理
采用改良Child法行PD重建,十二指肠-空肠吻合采用经横结肠前方吻合,常规使用防粘连剂。RAH患者均接受胸腹盆螺旋CT增强扫描进行术前分期,多数补充肝MRI检查。疑似恶性肿瘤病例均通过多学科肿瘤会议讨论,由肿瘤科医生制定手术决策。机器人手术方式由手术团队与患者共同决定。所有患者均签署知情同意书,知晓手术创新性及大规模临床试验结果尚未明确。
所有手术均使用达芬奇Xi手术系统。患者取仰卧位(法国体位),右半肝病变患者采用左侧卧位。采用开放法置入套管,维持<10 mmHg气腹压预防气体栓塞。患者取头高脚低反Trendelenburg位,补充置入套管后行诊断性腹腔镜检查。遇腹腔粘连致套管置入困难时,先行腹腔镜下粘连松解。
置入达芬奇Xi系统后,行术中超声检查评估肿瘤情况并辅助肝切除。
针对上腹部手术史导致的腹腔粘连,利用机器人多关节器械的稳定操作特性,结合气腹压力和放大视野,可安全实施精细解剖。特别是沿肠管与腹壁的切线方向进行粘连松解。常规游离肝十二指肠韧带并套带,预备肝门阻断(间歇性Pringle法),根据术者判断使用,最大阻断时间15分钟,间歇5分钟再灌注。PD术后患者因胆肠吻合或门静脉重建,肝门阻断实施困难,本院对于需大范围肝切除的病例,更倾向选择开腹手术以确保安全。
肝切除时,常规要求麻醉医师调控中心静脉压和呼气末正压以控制肝静脉出血。肝实质离断采用改良钳夹法,使用Maryland双极电凝钳和网孔双极电凝钳。助手通过两个辅助套管协助止血和吸引。细小血管直接通过达芬奇Xi系统的双极电凝离断;直径>3 mm的血管谨慎使用钛夹或Hem-o-lok夹结扎;粗大血管如肝静脉根部则使用自动吻合器。切除的肝组织装入取物袋,经略扩大的套管孔取出。肝断面附近置入闭式引流管后关闭腹腔。皮下组织闭合前用生理盐水冲洗伤口,使用可吸收缝线缝合腹壁。引流管根据分泌液质量于术后第2天拔除。
2.病例展示
本研究报告东京医科大学2024年3月至2025年3月连续实施的三例手术病例。
病例1
49岁男性,因胰头癌行开放PD联合门静脉切除及右半结肠切除,术后接受辅助化疗。2年后发现肝第5段转移灶(图1)。
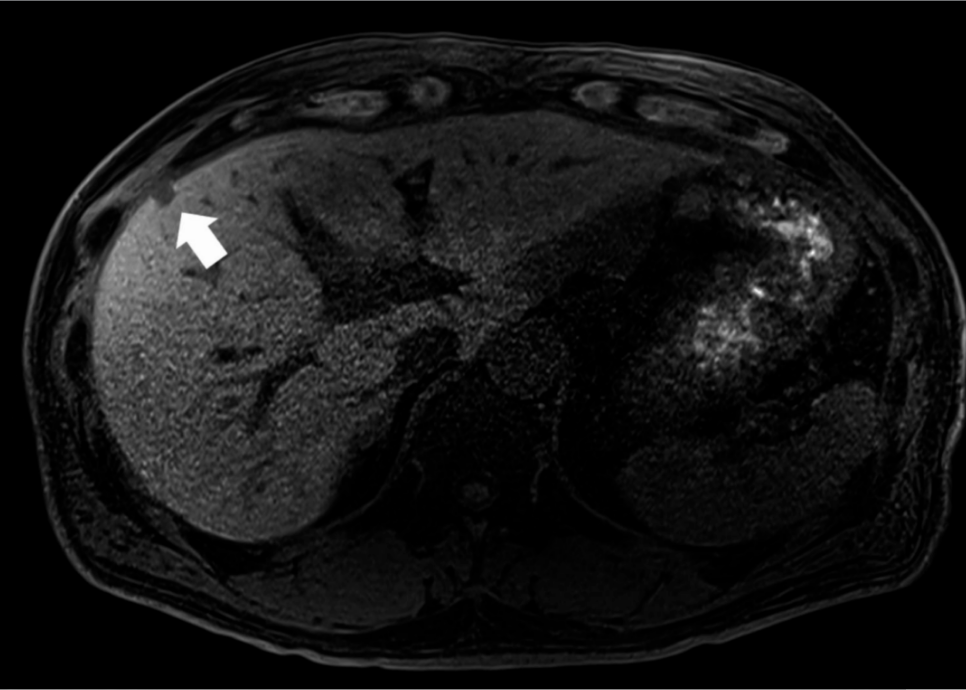 图1. 病例1肝T1期肝胆相MRI显示肝第5段表浅部位低信号小病灶(箭头)
图1. 病例1肝T1期肝胆相MRI显示肝第5段表浅部位低信号小病灶(箭头) 系统化疗采用吉西他滨+白蛋白结合型紫杉醇(GnP方案)23周期。无新发病灶且肝转移灶呈缩小趋势,遂行肝切除术。手术时长198分钟,出血量1 ml。术后恢复顺利,术后第8天出院。
病理示R0切除,切缘10 mm,胰腺源性低-中分化腺癌;浸润性导管癌,低-中分化腺癌(淋巴浸润3级,静脉浸润3级,神经浸润2级)。
CA19-9/CEA由术前14.7 U/ml/3.4 ng/ml变为27.4 U/ml/10.0 ng/ml,实体瘤疗效评价标准(RECIST)判定为疾病稳定(SD)。术后1年半无复发存活。
病例2
73岁女性,因壶腹癌行开放PD。术后9个月发现4 mm肝病灶,初诊为肝脓肿予以观察。1年后病灶缓慢增至10 mm,考虑恶性可能遂行肝切除。MRI显示肝第8段低信号病灶(图2)。
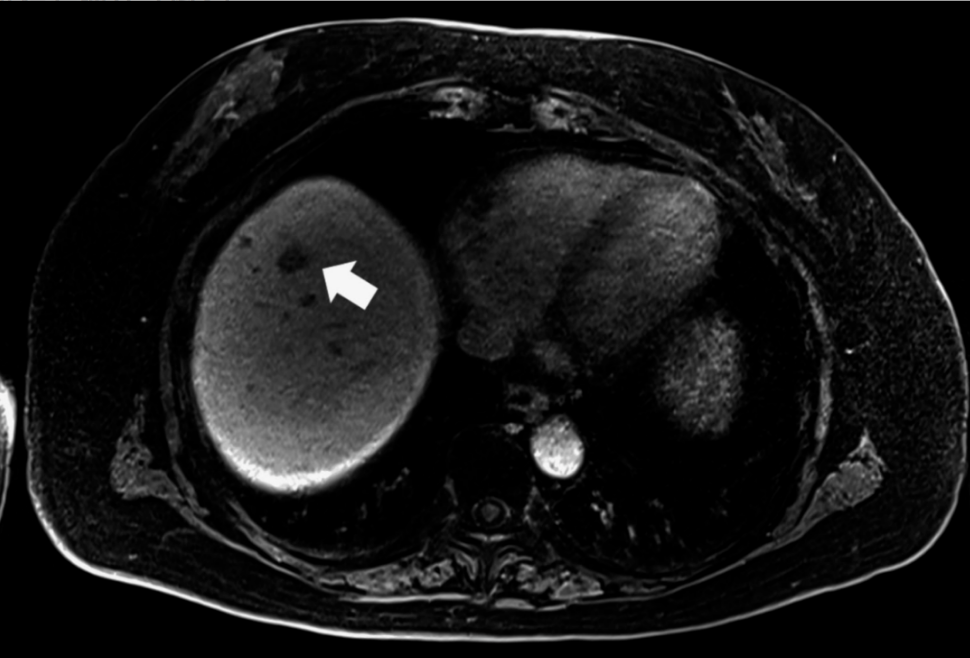 图2. 病例2肝T2期肝胆相MRI显示肝第8段小低信号病灶(箭头)
图2. 病例2肝T2期肝胆相MRI显示肝第8段小低信号病灶(箭头) 术前模拟影像显示病灶位于肝第8段Glisson鞘根部(图3)。
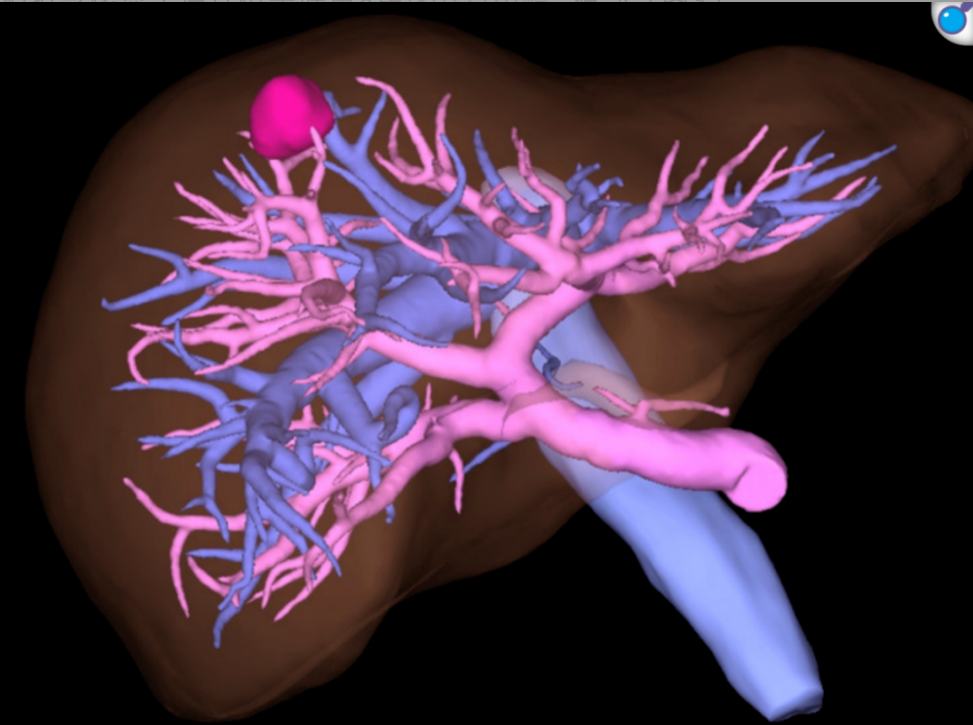 图3. 术前模拟影像显示病灶位于肝第8段Glisson鞘根部
图3. 术前模拟影像显示病灶位于肝第8段Glisson鞘根部 行RAH。首套管孔周围粘连在直视下谨慎松解后置入套管。全面评估腹腔粘连后,结合气腹压力和腹腔镜放大视野,机器人多关节钳协助精确松解PD术后横结肠与腹壁的广泛粘连。
术中超声显示病灶邻近肝第8段腹侧支。术者具有无Pringle法腹腔镜肝切除经验,在助手配合下安全实施肝实质离断。标记切除线后,使用Maryland双极电凝钳和网孔双极电凝钳配合内脏拉钩实施肝实质离断。精准游离并双重Hem-o-lok夹闭后离断肝第8段腹侧支。最后向颅侧离断肝实质完成肝切除(视频1)。
手术时长273分钟,出血量52 ml。术后出现手术部位感染(Clavien-Dindo II级),术后18天出院。病理示R0切除,切缘0 mm,十二指肠源性中-低分化腺癌;浸润性导管癌,中-低分化腺癌。CA19-9/CEA由术前8.5 U/ml/2.7 ng/ml变为12.2 U/ml/3.7 ng/ml。
肝切除术后2个月,患者因肺脓肿(图4)再次入院,病灶位于肝切除部位邻近右肺区域。
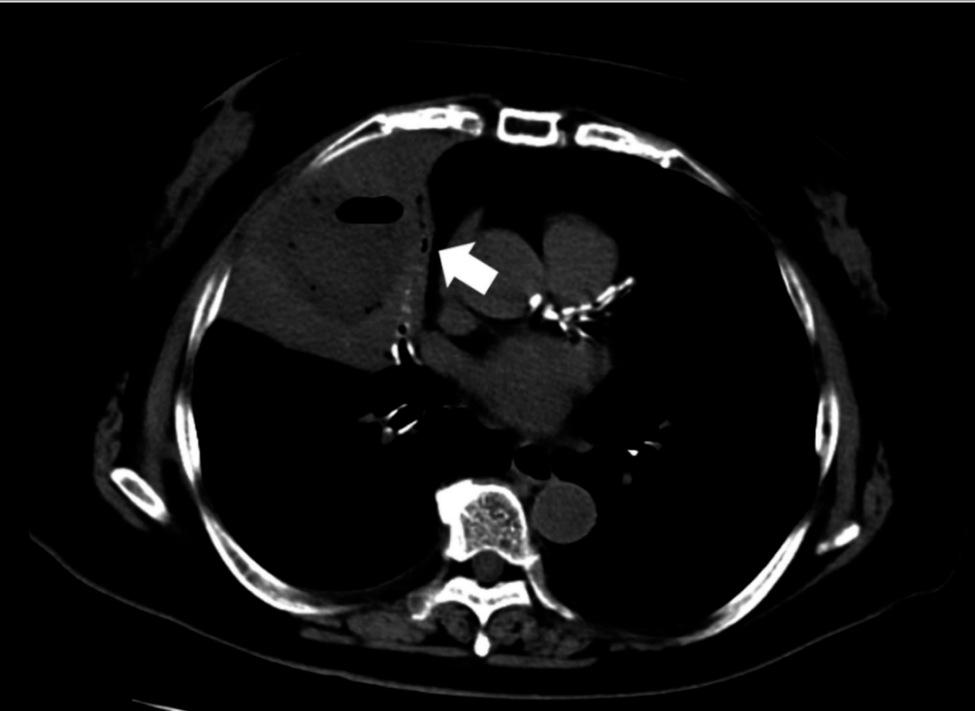 图4. 病例2再次入院时CT显示右肺邻近肝切除部位含气液平面病灶(箭头)
图4. 病例2再次入院时CT显示右肺邻近肝切除部位含气液平面病灶(箭头) 经抗生素治疗后病灶改善,考虑为肝断面脓肿继发。保守治疗后好转,术后10天无并发症出院。术后9个月无复发存活。
病例3
65岁女性,胰头癌行开放PD联合门静脉切除并术后辅助化疗后出现肝转移。
PD术后14个月发现肺转移,予S-1化疗2周期。2个月后发现肝转移,改用GnP二线化疗。8周期化疗后肺肝转移灶均呈缩小趋势,遂行肝切除术。CT显示肝第5段病灶(图5)。
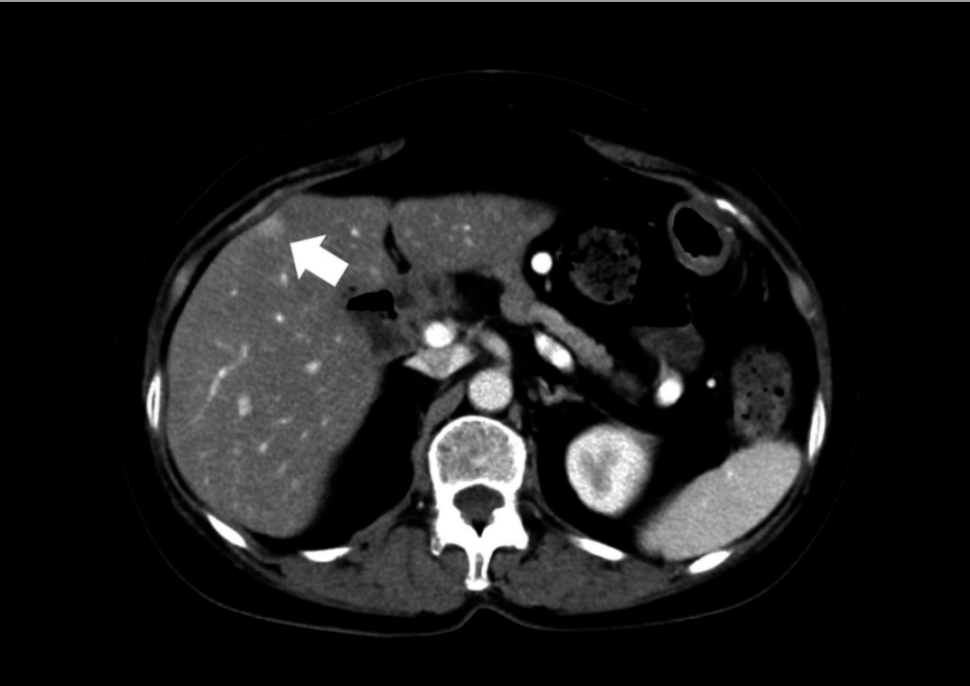 图5. 病例3CT显示肝第5段表浅部位早期强化小病灶(箭头)
图5. 病例3CT显示肝第5段表浅部位早期强化小病灶(箭头) 行RAH。手术时长161分钟,出血量197 ml。术后第8天无并发症出院。病理示R0切除,切缘15 mm,胰腺源性低-中分化腺癌;高分化腺癌(淋巴浸润2级,静脉浸润2级,神经浸润2级)。CA19-9/CEA由术前31 U/ml/4.8 ng/mlL变为32.8 U/ml/4.6 ng/ml,RECIST判定为疾病稳定。术后1个月行胸腔镜右中肺叶转移灶切除,术后第5天无并发症出院。术后6个月无复发存活。
上述三例患者手术中位时长198分钟,中位出血量52 ml。无严重术后并发症或复发,患者预后良好。
病例分析
当前指南不推荐将肝切除术作为胰腺或胆道癌肝转移的一线治疗方案,而系统化疗通常是标准治疗手段。关于胰十二指肠切除术后肝转移灶切除的疗效尚无明确证据,其适应证被认为较为有限。需强调的是,相关证据仍不充分,需建立多学科选择标准并整合系统治疗。据既往报道,异时性肝转移的预后显著优于同时性肝转移(11.4个月 vs. 9.1个月;P=0.038)。此外,Tsutsumi等报告了胰腺癌术后肝转移切除后长期生存的病例,提示此类手术可能在部分病例中改善预后。
病例报告及不断积累的病例系列显示,对于既往有上腹部手术史的患者,机器人手术具有多关节器械稳定性及3D视野等优势。本研究实施RAH的3例病例均符合以下特征:(1) 开放PD术后;(2) 异时性肝转移;(3) 肝表面<2 cm的小肿瘤。对于肝表面肿瘤(如S7、S2、S1段)或胆肠吻合口附近肝门部的肿瘤,RAH可能适用,其功能优势在特定病例中尤为显著。这些因素可能共同促成了RAH的安全实施及良好的长期预后。
既往腹部手术可能导致腹腔粘连,尤其是腹腔镜操作存在技术挑战。但Feldbrügge等研究表明,上腹部手术史并非RAH术后并发症的风险因素,与无手术史患者相比,手术时长、中转率及严重术后并发症发生率均无显著差异。单因素分析显示,有肝切除史的患者手术时长更长。因此,对于有上腹部手术史的患者,RAH可能具有优势。然而,PD作为最广泛的上腹部手术之一,术后RAH的病例报道极少。本研究中,即使存在广泛粘连,通过机器人多关节钳仅剥离必要粘连区域,仍实现了良好的短期术后结局。
PD术后因肝十二指肠韧带解剖、胆肠吻合及门静脉重建,肝门阻断实施困难。即使Pringle操作受限,通过气腹压力、精准肝切除技术及助手配合仍可安全完成肝切除。本病例系列中未应用Pringle操作。所有病例均为肝表面<2 cm的小肿瘤,结合开放PD术后使用的防粘连膜及本院丰富的MIH(含机器人辅助)经验,可能促成了良好的短期结局。但本研究所有病例均为相对较小的部分切除,对于需大范围肝切除的病例,MIH的适用性尚不明确。
尽管消融疗法(如RFA)在胆肠吻合术后侵袭性较小,但存在术后肝脓肿高风险,故不推荐。
1例病例因肺脓肿需再次入院,推测为肝切除部位脓肿经横膈蔓延所致。经抗生素保守治疗改善。胆肠吻合术后肝切除的感染并发症是主要问题。胆肠吻合导致肠道细菌定植于胆汁,肝切除后易形成脓肿。本例推测肠源性细菌经胆肠吻合口感染肝第8段切面,并可能通过横膈蔓延至肺部形成脓肿。因此,对于胆肠吻合术后肝切除,需比无胆肠吻合的肝切除更重视晚期感染防控,如置管期间确认胆汁细菌培养、针对性使用抗生素、选择性引流、发热时早期影像检查及明确引流管拔除标准。
综上,尽管PD术后转移性肝肿瘤行MIH因广泛粘连及肝门阻断困难存在挑战,但通过机器人技术可安全实施RAH并获得可行的短期预后。在严格筛选的PD术后小(<2 cm)、表浅、晚期转移患者中,RAH显示出安全可行性及良好的短期预后(6~18个月)。当然,未来仍需开展倾向匹配比较、系统治疗时间窗、生活质量及成本/资源分析等研究。
参考文献:Kanazawa A, Kosaka A, Oguma J, Koga H, Nagakawa Y. Robotic-Assisted Hepatectomy After Pancreaticoduodenectomy: A Three-Case Series. Cureus. 2025 Oct 14;17(10):e94527. doi: 10.7759/cureus.94527. PMID: 41246584; PMCID: PMC12612778.
- 推荐文章
2025 CCHIO大会CACA-Cancer Discovery专场圆满召开
CCHIO 2025丨王贵玉教授:2025版CACA结直肠癌诊疗指南三大核心更新深度解读
岂有此“例”丨胰十二指肠切除术后机器人辅助肝切除术安全实践——三例超晚期肝转移瘤微创治疗经验与筛选策略
ESMO Asia 2025丨胃肠肿瘤口头报告摘要揭晓,中国学者领衔8项突破性成果领跑亚洲
CCHIO 2025丨刘秀峰教授:双免 vs. 靶免一线之争,答案藏在细分与协同里
CCHIO 2025丨邓艳红教授:从技术切除到生物学治愈,结直肠癌转化治疗的优化与探索
重磅前瞻|2026 ASCO GI研讨会主旨演讲:Rathmell博士解码医患协作核心力量
2025 CCHIO丨陈凛教授:CACA胃癌诊疗指南再更新,推动我国规范化、精准化诊疗基层落地
CCHIO 2025丨陈小兵教授:“以人为本、赢在整合”——开启胆道胰腺肿瘤精准治疗新征程
CCHIO 2025丨袁瑛教授:RAS靶向治疗破局前行,双抗与ADC开启肠癌治疗新篇
凝聚协作共识,共绘全球癌症防治蓝图——2025 CCHIO国际研讨会Ⅰ圆满召开
国际视野丨一表带您看懂肝癌局部治疗如何抉择?
“把握当下:癌症研究塑造患者照护的未来”——2026 ASCO GI热点抢先知!
周总光教授揭秘结直肠癌转移基因组全新进化模式如何重塑外科临床决策丨第十届国家癌症中心结直肠癌学术会议
对话梅奥诊所专家:AI在肿瘤诊疗中的临床应用与未来挑战丨国家癌症中心结直肠癌学术会议 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025年11月7日 18:06 听全文
顾晋教授:AI浪潮下,外科医生的坚守与革新丨第十届国家癌症中心结直肠癌学术会议
蔡三军教授:解码大肠癌MDT核心精髓,展望3.0智能融合新图景丨第十届国家癌症中心结直肠癌学术会议
岂有此“例”丨反常规病例!一例MSI-H转移性结肠癌患者免疫治疗失败的病例报告
国际视角丨寡转移性食管胃癌治疗现状与最新研究进展
王锡山教授:顺应时代发展潮流,深入推广NOSES技术,实现患者“微创”目标
刘骞教授:以精细技术筑规范之基,以精准诊疗谋预后之优丨国家癌症中心结直肠癌学术会议
Ⅲ期临床研究证实术后保持良好运动习惯显著改善患者生存
许剑民教授:REAL研究首次证实机器人手术在中低位直肠癌中具有减少局部复发和保护器官功能的双重优势
ESMO 2025前沿丨胰腺癌研究日益聚焦ADC药物与溶瘤病毒
ESMO LBA专访|遗憾!IMbrave152研究未达主要终点,TIGIT抗体未能给晚期肝癌的一线治疗增效
ESMO 2025前沿丨三项口头报告证实新免疫联合策略将突破肝癌治疗局限
京华秋韵 术启未来丨第十届国家癌症中心结直肠癌学术会议在京隆重召开!
ESMO CHINA FOCUS中国视角论坛丨消化肿瘤专场:替雷利珠单抗引领治疗革新,精准策略点亮临床未来
ESMO 2025前沿丨晚期神经内分泌肿瘤新型放射治疗疗效值得期待
ESMO 2025丨FORTITUDE-101研究初步OS结果公布,可能不具备临床意义
岂有此“例”丨全球首例胃型十二指肠癌+胃癌碰撞瘤,术前诊断难点全解析
ESMO 2025丨重磅!三大新策略破解免疫治疗耐药困局,多线治疗失败患者迎曙光!
ESMO 2025丨KRAS G12D/V靶向治疗全面破局,四大研究改写实体瘤治疗格局
ESMO 2025国际视野丨ESMO特别贡献奖获得者Thierry Conroy教授追溯消化道肿瘤治疗变革
ESMO 2025前沿丨“冰火两重天”——HER2靶向治疗GC/GEJC令人惊喜,免疫联合折戟成沙
ESMO 2025 AI热潮来袭:大会主席专访定调转型方向,结直肠癌研究彰显临床价值
2025 ESMO速递丨胰腺癌新药研究取得突破,生物标志物指导PDAC个性化治疗
ESMO 2025丨重磅!KRAS G12C抑制剂多点突破,耐药与难治性实体瘤患者迎来新曙光
2025 ESMO速递:“靶免联合”拓展胃癌精准治疗新视野
高危胃肠道间质瘤(GIST)术后辅助治疗的五大争议与决策
胃食管交界部癌的多模式治疗:现状与未来方向丨2025韩国国际胃癌周
Jeeyun Lee教授解析多组学技术如何重塑胃癌免疫微环境丨2025韩国国际胃癌周
王绿化教授解析食管癌临床研究新进展:免疫治疗引领格局变革,中国原创方案重塑国际标准丨CSCO 2025
Nature Medicine丨AI赋能结直肠癌手术:个性化围手术期治疗的临床突破与未来方向
Joo Ha Hwang教授详解胃癌一、二级预防全球行动丨2025韩国国际胃癌周
食管鳞癌新辅助治疗迎来新突破!化免方案VS放化疗,生存、复发数据全面对比
李健教授:探索胃肠间质瘤联合治疗新策略,攻克TKIs耐药难关丨CACA东北整合肿瘤学大会 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025-09-30 19:15:32 河北 手机阅读
共探胃癌诊疗新路径!2025韩国国际胃癌周中韩专场顺利举办,四大前沿研究擘画治疗未来
CACA东北整合肿瘤学大会丨徐泽宽教授:精准治疗时代胃癌诊疗机遇和挑战并存
应杰儿教授:以“整合”破局胃癌诊疗难题,以“康复”守护患者长期预后丨2025CACA东北整合肿瘤学大会
王峰教授展望未来食管癌精准免疫治疗新策略丨CSCO名家演讲集
ESMO 2025丨LBA重磅发布,消化道肿瘤领域最新进展一文纵览!
王峰教授:食管癌免疫治疗2.0时代:新联合策略+耐药探索丨CSCO名家演讲集
CACA东北整合肿瘤学大会丨李茂全教授:建立“诊、治、康、护、养”完整诊疗体系,推动胰腺癌个体化和规范化诊疗 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025年9月25日 18:20
聚焦胃癌肝转移诊疗新进展:陈凛教授解析外科价值与多学科协作策略丨2025CACA东北整合肿瘤学大会
