- 首页 > 正文
王峰教授展望未来食管癌精准免疫治疗新策略丨CSCO名家演讲集
发表时间:2026-01-30 13:04:43
专家简介

王峰 教授
郑州大学第一附属医院 郑州大学第一附属医院 主任医师、教授、博士生导师、肿瘤科病区主任、党支部书记 河南省卫生科技领军人才、美国Georgetown大学访问学者 河南省卫生健康中青年学科带头人、《食管疾病》杂志副主编
2020年“人民好医生.金山茶花计划”杰出贡献奖(食管癌领域)
国际食管疾病协会(CSDE)中国分会 理事
中国临床肿瘤学会(CSCO) 理事
中国临床肿瘤学会(CSCO)食管癌专家委员会 常委
中国临床肿瘤学会(CSCO)胃癌、肝癌、胰腺癌专委会委员
中国医药教育协会肿瘤药物临床研究专委会 常委
国家癌症中心食管癌质量控制专家委员会 委员
北京癌症防治协会食管癌、胃癌专委会 副主委、常委
河南省医学会肿瘤分会食管癌学组 副主委、组长
河南省临床肿瘤学会食管癌专委会 副主委
河南省抗癌协会肿瘤药物临床研究专委会 副主委、青委主委
河南省抗癌协会食管癌专委会 副主委、青委主委
河南省研究型医院学会消化道肿瘤内科学专委会 主委
河南省抗癌协会肉瘤专委会 主委
河南省食管癌临床转化工程研究中心实验室主任
河南省消化道肿瘤免疫耐药及转化研究国际联合实验室主任
主持有国自然面上、省重点项目,发表有Lancet G & H、Mol Cancer、JAMA Int Med、Eur J Cancer等论文,主编《CSCO食管癌患教手册》、参编国家卫健委《食管癌诊治规范》、《消化系统肿瘤合理化用药指南》、《CSCO食管癌诊治指南》等。
食管鳞癌免疫治疗当前的研究难点主要有两点:一是疗效有限,易耐药,难以使患者长期获益。解决第二个难点的关键在于建立食管癌的分子分型体系。食管鳞状细胞癌表现出高度的分子异质性,这是导致免疫治疗失败以及复发转移的重要原因。目前,基于多组学数据的分子分型研究已成为重要方向。
上海市胸科医院李志刚教授团队的NICE研究长期结果显示:ESCC免疫治疗应答与耗竭CD8+T细胞的异质性有关;耗竭前体T细胞(CD8+Tex-SPRY1细胞)可作为ESCC免疫检查点抑制剂疗法特异性预测疗效和改善生存的指标(图1)。北大肿瘤的鲁智豪教授团队对阿法替尼治疗EGFR过表达食管鳞癌II期研究进行亚组分析发现,NTRK2可以更精准预测阿法替尼疗效,靶向NTRK2增强阿法替尼抗肿瘤效果。鲁智豪教授团队基于随机、Ⅲ期RATIONALE-302研究的生物标志物研究发现,NOTCH1突变可作为ESCC患者接受替雷利珠单抗治疗的预测生物标志物,其可能通过改变肿瘤微环境来增强免疫治疗效果。该研究为NOTCH通路作为ESCC的免疫治疗靶点提供了理论依据。郑州大学第一附属医院王峰教授牵头的“盐酸安罗替尼联合贝莫苏拜单抗治疗晚期食管鳞癌的单臂、多中心探索性临床研究”发现,安罗替尼联合贝莫苏拜单抗治疗携带特定基因类型(TP53+/FAT1+NOTCH3-)的晚期食管鳞癌患者的ORR、PFS和OS显著获益。“TP53+/FAT1+NOTCH3-”基因特征可指导食管鳞癌患者无化疗“免靶”方案的选择。
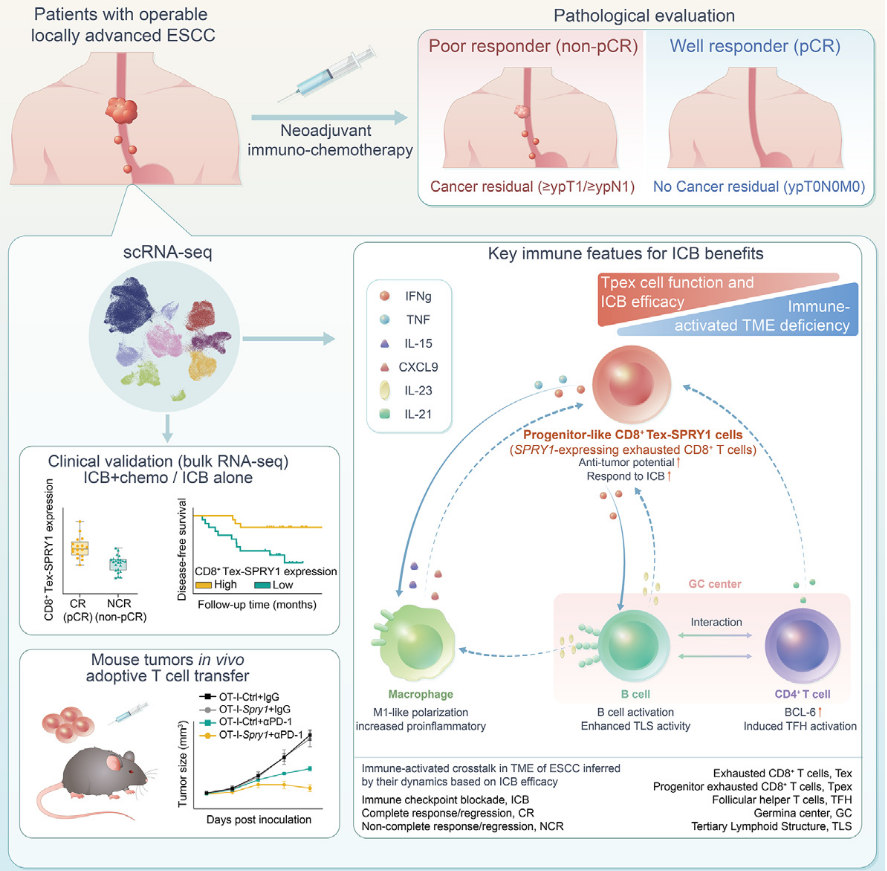
图1.ESCC免疫治疗应答与耗竭CD8+T细胞的异质性有关
在晚期食管鳞癌“化疗+PD-1抗体”联合治疗模式下,中山大学肿瘤防治中心徐瑞华教授团队对JUPITER-06随机研究中进行免疫治疗的基因组生物标志物进行探索,95%患者的肿瘤标本进行全外显子测序(WES),确定了几种免疫肿瘤学特征(即ccTMB、特异性HLA基因型和四种风险致癌变异)作为区分晚期ESCC患者一线“化疗+PD-1抗体”联合治疗结局的可靠生物标志物(图2)。通过对优化的免疫原性指标和耐药相关的风险致癌变异进行多维度整合,构建了可以精准预测“化疗+PD-1抗体”联合治疗获益的EGIC分型,促进了晚期ESCC免疫治疗的个体化决策。同时,EGIC分型为进一步探索更有效的晚期ESCC免疫-靶向联合治疗策略提供了新方向,并为未来进行生物标记物探索提供了范例,具有可观的转化前景。
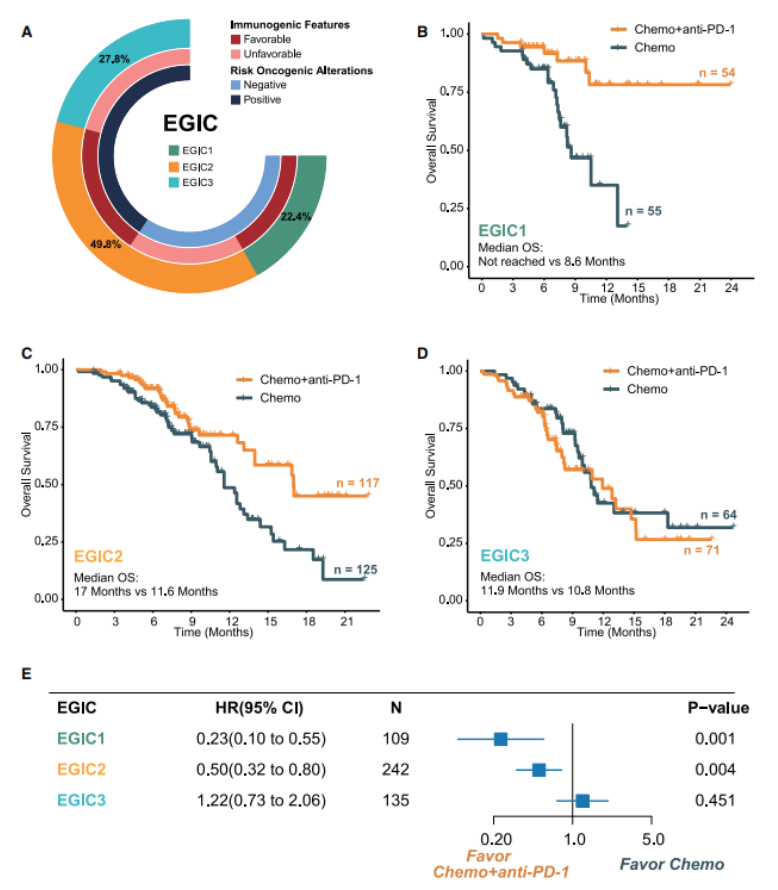
图2. 基于基因组的食管癌免疫肿瘤分型指导精准免疫治疗策略
2023年,北京大学詹启敏、中国医学科学院刘芝华和焦宇辰、深圳湾实验室崔永萍合作团队对155例食管鳞癌患者采用全基因组、全基因组甲基化、转录组测序、microRNA测序、蛋白质组学组合分析开展食管鳞癌研究,将食管鳞癌分为四种类型:细胞周期通路激活型(CCA)、NRF2通路激活型(NRFA)、免疫抑制型(IS)和免疫调节型(IM)(图3)。基于多组学整合分析,首次将食管鳞癌进行精准分子分型,制定了食管鳞癌分子分型分类标准,有望助推食管鳞癌患者进行精准诊疗。此外,研究发现了更多食管鳞癌患者的特异靶点,为后续开展针对食管鳞癌的药物研发、临床试验提供数据和证据的支持。
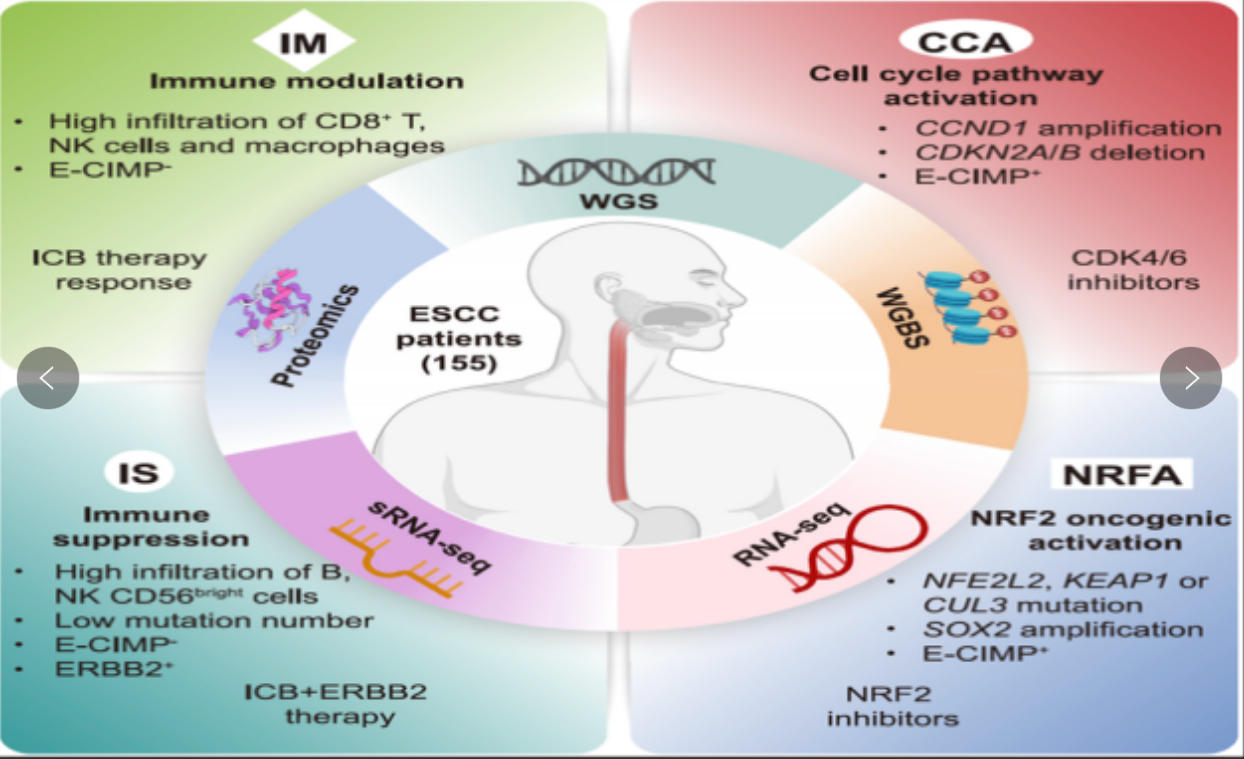
图3.食管癌多组学分子分型
小结
近年来,随着大量临床研究结果的不断更新,免疫治疗已然成为食管癌患者的重要治疗手段,参与食管癌治疗的多个环节。晚期食管癌的免疫治疗已经成为了不可撼动的主要疗法。然而,免疫治疗存在缺乏基于分子层面的分型体系,整体人群有效率及获益率低、易耐药、耐药机制未明和缺乏耐药后的临床研究等问题。未来研究方向应为:筛选出食管癌免疫治疗的潜在预测生物标记物,优化免疫治疗策略;明确食管癌免疫原发耐药及继发性耐药机制,发现重塑食管癌免疫微环境并逆转免疫耐药的联合治疗靶点,选择或开发相应的药物,优化免疫治疗方案,进而克服免疫原发性及继发性耐药。建立食管癌分子分型体系,实现精准的个体化治疗。实现以上目标需要利用我国食管癌病例资源优势,加强转化医学、基础医学及临床医学的学科交叉及多学科合作,为食管癌的精准治疗找到突破性方向,为“健康中国2030”提供有力的保障。
- 推荐文章
