- 首页 > 正文
王峰教授:食管癌免疫治疗2.0时代:新联合策略+耐药探索丨CSCO名家演讲集
发表时间:2026-01-30 12:43:14
编者按 2025年9月10日~14日,第28届全国临床肿瘤学大会暨2025年中国临床肿瘤学会(CSCO)学术年会在山东济南召开。本届年会以“规范诊疗,创新引领”为主题,汇聚全球肿瘤领域专家,分享前沿成果与经验。会议期间,郑州大学第一附属医院的王峰教授详细阐述了晚期食管癌免疫治疗的最新进展,小编今天为您分享食管癌免疫治疗之上篇——免疫治疗2.0时代:新联合策略+耐药探索。
专家简介

王峰 教授
郑州大学第一附属医院 郑州大学第一附属医院 主任医师、教授、博士生导师、肿瘤科病区主任、党支部书记 河南省卫生科技领军人才、美国Georgetown大学访问学者 河南省卫生健康中青年学科带头人、《食管疾病》杂志副主编
2020年“人民好医生.金山茶花计划”杰出贡献奖(食管癌领域)
国际食管疾病协会(CSDE)中国分会 理事
中国临床肿瘤学会(CSCO) 理事
中国临床肿瘤学会(CSCO)食管癌专家委员会 常委
中国临床肿瘤学会(CSCO)胃癌、肝癌、胰腺癌专委会委员
中国医药教育协会肿瘤药物临床研究专委会 常委
国家癌症中心食管癌质量控制专家委员会 委员
北京癌症防治协会食管癌、胃癌专委会 副主委、常委
河南省医学会肿瘤分会食管癌学组 副主委、组长
河南省临床肿瘤学会食管癌专委会 副主委
河南省抗癌协会肿瘤药物临床研究专委会 副主委、青委主委
河南省抗癌协会食管癌专委会 副主委、青委主委
河南省研究型医院学会消化道肿瘤内科学专委会 主委
河南省抗癌协会肉瘤专委会 主委
河南省食管癌临床转化工程研究中心实验室主任
河南省消化道肿瘤免疫耐药及转化研究国际联合实验室主任
主持有国自然面上、省重点项目,发表有Lancet G & H、Mol Cancer、JAMA Int Med、Eur J Cancer等论文,主编《CSCO食管癌患教手册》、参编国家卫健委《食管癌诊治规范》、《消化系统肿瘤合理化用药指南》、《CSCO食管癌诊治指南》等。
多项随机对照研究为晚期食管癌一线单免联合化疗奠定地位,目前免疫联合化疗是国内外权威指南共同推荐的晚期食管癌一线标准方案。食管鳞癌免疫治疗当前的研究难点主要有两点:一是疗效有限,易耐药,难以使患者长期获益。PD-1抗体一线治疗晚期食管癌有效率为40%~70%,中位总生存期(mOS)仅12~18个月。此外,中国晚期食管癌患者获得性免疫耐药率高达48.8%,获得性免疫耐药患者95%发生在2年内。二是缺乏基于分子层面的分型体系,难以实现精准的个体化治疗。
解决第一个难点的关键在于优化晚期食管癌一线治疗方案,以及克服免疫耐药。精准、联合、多模式免疫治疗即免疫2.0时代是未来食管癌优化一线治疗和克服免疫耐药的方向。
靶向VEGF
临床前研究发现,抑制肿瘤免疫逃逸和抗肿瘤血管生成具有协同作用。以“VEGF”为主要靶点的TKIs药物,可有效抑制肿瘤血管新生促进血管正常化,增加其他抗肿瘤药物的递送,抑制肿瘤细胞增殖、迁移并改善肿瘤微环境,在联合治疗中发挥协同增效的作用。
ALTER-E003研究是一项单臂、多中心、开放标签的Ⅱ期临床研究,探索安罗替尼联合贝莫苏拜单抗(TQB2450,PD-L1抑制剂)一线治疗晚期ESCC的疗效和安全性,研究的主要研究终点为ORR,次要研究终点为安全性、PFS、DCR、DoR和OS。2022年3月至2022年9月,共纳入46例经组织病理学确诊的不可切除局部晚期、复发性或转移性ESCC患者,且既往未接受过系统治疗。给予安罗替尼(12 mg,po,d1-14,q3w)联合贝莫苏拜单抗(1200 mg,iv,d1,q3w)治疗直至疾病进展或不可耐受。截至2024年2月,经确认最佳疗效结果显示,ORR为56.52%(95%CI:41.11%~71.07%),DCR为91.30%(95%CI:79.21%~97.58%)。中位PFS为15.74月,中位OS为20.57月,中位DoR为17.81月,3级及以上TRAEs发生率28%(图1)。该研究是首个“免疫检查点抑制剂联合VEGF-TKI”的“去化疗”方案,初步研究结果表明,安罗替尼联合贝莫苏拜单抗一线治疗晚期ESCC具有卓越的疗效和良好的安全性。基于上述结果,2025年CSCO食管癌指南中,在晚期食管鳞癌一线治疗推荐中,对于存在化疗禁忌或拒绝化疗的患者,注释部分推荐可尝试应用安罗替尼联合贝莫苏拜单抗治疗。
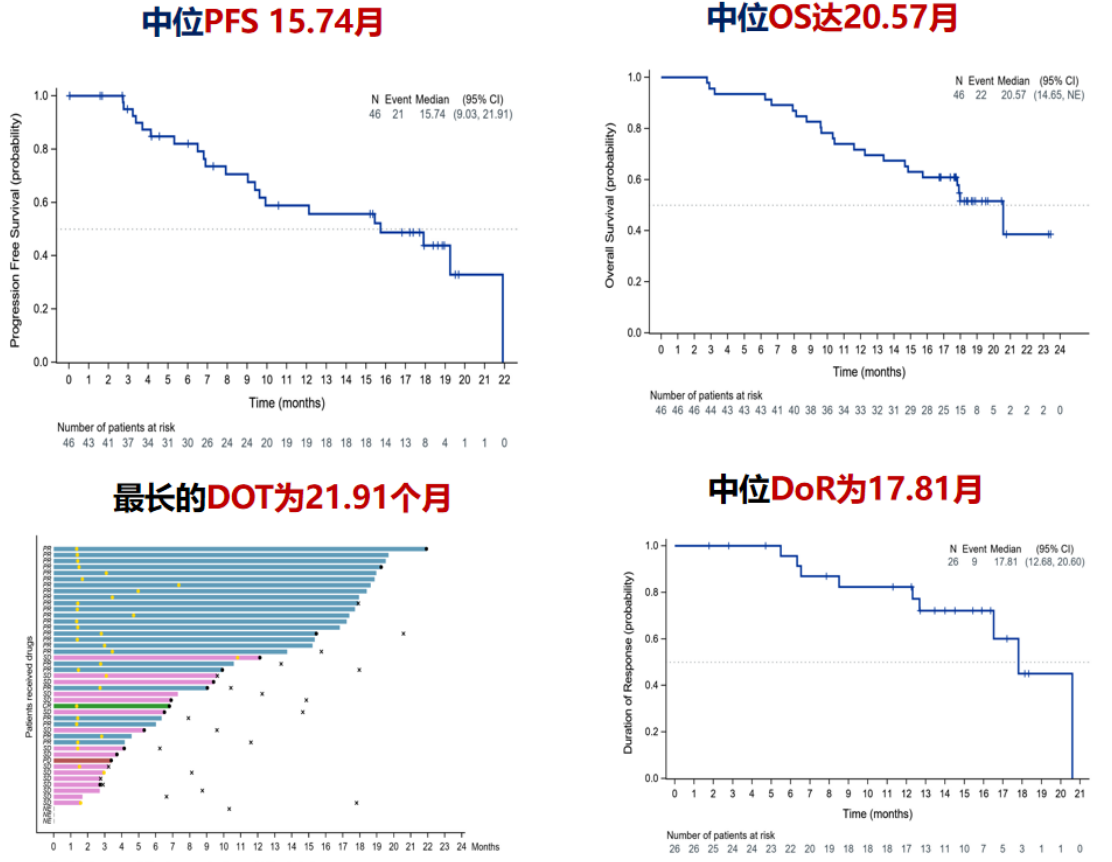
图1. ALTER-E003研究主要疗效结果
在免疫联合抗血管生成药物二线治疗食管癌领域,卡瑞利珠单抗联合阿帕替尼二线治疗晚期ESCC患者的CAP02研究中的队列1纳入的人群为一线化疗失败的晚期ESCC患者,经确认的ORR达34.6%,PFS中位数为6.8个月,OS中位数达15.8个月。该结果提示免疫治疗联合抗血管生成药物在晚期ESCC二线中存在明显的协同作用,成果已发表于《柳叶刀》子刊The Lancet Gastroenterology & Hepatology,该方案已经纳入CSCO食管癌诊治指南。卡瑞利珠单抗联合阿帕替尼二线治疗晚期ESCC患者的CAP02研究中的队列2纳入了在一线免疫联合化疗中进展或不耐受的晚期ESCC患者,主要终点为ORR,次要终点包括DCR、PFS、DoR、OS和安全性等,队列2共纳入49例患者,38例患者纳入疗效分析,截至2023年6月20日,中位随访时间为5.2个月,在疗效分析集中,ORR为36.8%,确认的ORR为13.2%,DCR为89.5%。中位DOR为3.0个月,中位反应时间为2.2个月。中位PFS为4.6个月,3个月和6个月PFS率分别为73.1%和35.4%,中位OS为7.5个月,6、9、12个月的OS率分别为61.9%、46.1%和35.7%。此外,PD-L1阳性且对既往ICI有应答的患者具有最长的PFS(5.7个月,95%CI:3.9~未达到)和OS(9.6个月,95%CI:7.5~未达到)。安全性方面,35例(71.4%)患者出现了各种级别的TRAE,17例(34.7%)患者出现了≥3级TRAE,9例(18.4%)患者出现了治疗相关的SAE。12例(24.5%)患者报告了可能的irAE,24例(49.0%)患者因TRAE导致停药,其中,因TRAE导致卡瑞利珠单抗停药和阿帕替尼停药的人数分别为16例(32.7%)和23例(46.9%),无5级TRAE的发生。该研究显示,卡瑞利珠单抗联合阿帕替尼方案在免疫联合化疗耐药的食管癌患者中显示较好疗效,且安全性可接受,亚组分析提示PD-L1阳性且对既往ICI有应答的患者更适合采用免疫跨线治疗选择。研究结果发表于European Journal of Cancer。
ALTER-E-006研究回顾性分析了安罗替尼联合免疫检查点抑制剂治疗既往免疫经治的晚期食管鳞癌的多中心、真实世界数据,研究结果在2023年6月的欧洲肿瘤内科学会-胃肠道肿瘤大会(ESMO-GI)上进行了报道。研究共纳入96例既往接受过一种PD-1/PD-L1/CTLA-4药物(单药或联合)治疗失败的受试者,在71例可评效受试者中,ORR为29.6%,DCR为91.5%;96例受试者的中位OS达10.97个月,中位PFS达6.31个月。基于上述结果,2024年CSCO食管癌指南中,对既往接受过免疫检查点抑制剂联合化疗或单药治疗失败的晚期食管鳞癌患者,注释部分推荐可尝试应用安罗替尼联合免疫检查点抑制剂治疗。
靶向EGFR
EGFR通常在超过50%的ESCC患者中高表达,是治疗ESCC的潜在靶点。近几年研究发现,抗EGFR单抗除了可抑制肿瘤细胞增殖、诱导分化、促进细胞凋亡等抗肿瘤效果外,还存在增强抗肿瘤免疫应答的作用。ICI和抗EGFR单抗联合可以充分调动适应性免疫和先天免疫系统对抗肿瘤。
郑大一附院王峰教授发起的一项河南多中心、单臂Ⅱ期临床研究评估了卡瑞利珠单抗联合尼妥珠单抗二线治疗晚期ESCC患者的疗效和安全性。该研究结果于2025 ASCO摘要中报道。受试者均接受卡利瑞珠单抗200 mg,q2w,联合尼妥珠单抗400 mg,qw,每4周为1个周期,主要终点为ORR和OS。次要终点包括DCR、PFS和安全性。共纳入46例患者,其中21例之前使用过抗PD-1/PD-L1抗体。整体人群的ORR为32.6%(15/46),DCR为83%(38/46),中位随访19.88个月,中位PFS为9.4个月,中位OS为12.68个月,9个月和12个月生存率分别为73%和58%。在安全性方面,≥3级的TRAE为9%(4/46),其中4例与卡瑞利珠单抗相关,无与尼妥珠单抗相关病例。
2023ASCO会议上由中国医学科学院黄镜教授牵头的一项评估HLX07单药(抗EGFR单抗)或联合治疗用于局部晚期不可切除/转移性ESCC患者的Ⅱ期研究中,A组纳入的为未接受过系统性药物治疗的晚期一线患者,给予HLX07联合信迪利单抗及化疗(顺铂+5-氟尿嘧啶);B组纳入的为一线免疫联合化疗治疗失败或至少两种其他系统性抗肿瘤治疗失败的患者,给予HLX07单药治疗(1000 mg,每两周一次静脉输注)。研究纳入30例一线治疗患者,ORR为60.0%,中位PFS为7.8个月,中位DOR为7.2个月。14例(46.7%)发生3~4级治疗相关不良事件。HLX07单药在20例免疫治疗失败患者中的ORR为15.0%,中位PFS1.5个月,中位DOR未达到,仅2例(10.0%)出现3~4级不良事件。
北京大学肿瘤医院沈琳教授团队的研究显示,阿法替尼二线治疗41例EGFR过表达转移性ESCC患者(38例可评估),ORR达39%,DCR达79%,中位PFS为3.7个月,OS为7.8个月,显著优于历史数据。3~4级不良事件包括腹泻(10%)、口腔炎(7%)等,无治疗相关死亡,提示其对EGFR过表达人群的潜在临床价值。
此外,近期有一项研究对中国ESCC患者进行了大样本全基因组测序(WGS)和RNA-seq分析,以检验EGFR靶向CAR-T细胞治疗ESCC的可行性。研究发现肿瘤中的EGFR基因扩增和过表达水平比正常组织都明显升高,表明EGFR可能是CAR-T细胞免疫治疗ESCC的一个有希望的靶点。研究人员测试了EGFR靶向CAR-T细胞对ESCC细胞的裂解活性,作为建立ESCC细胞免疫疗法的模型,还构建了5种靶向EGFR的CAR-T细胞,其中CAR1-T和CAR2-T在体外和体内实验中均对ESCC表现出较强的细胞毒性(图2)。本研究结果提示,CAR1-T和CAR2-T有潜力用于临床抗食管癌的免疫治疗。
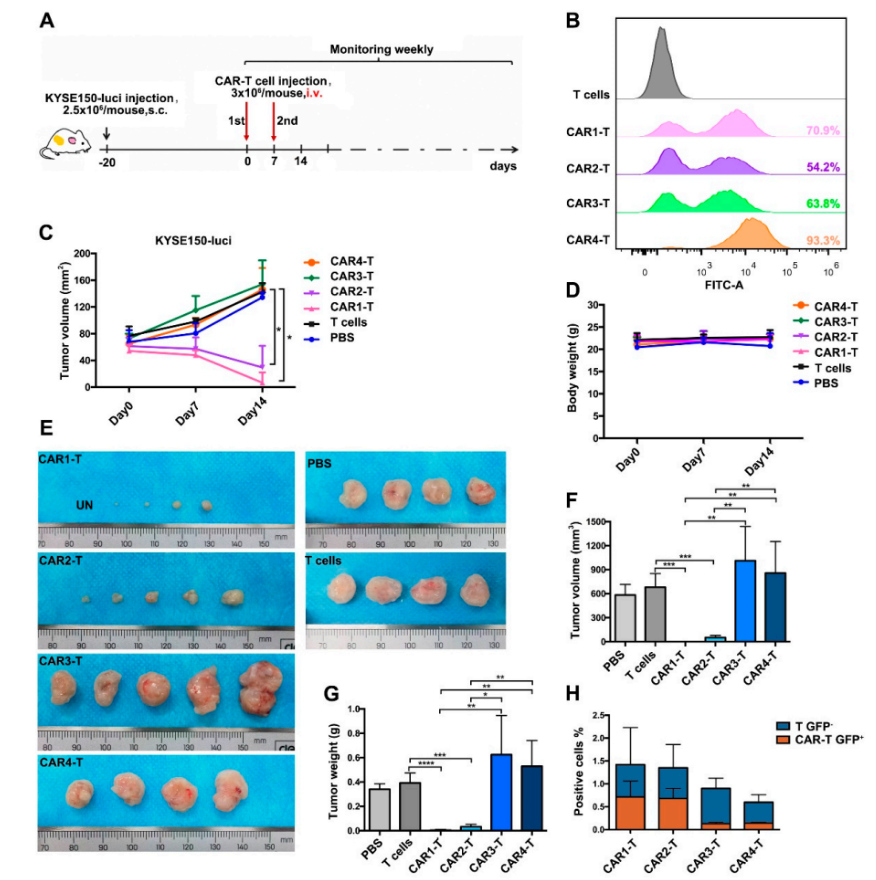
图2. EGFR特异性CAR-T细胞在抑制食管鳞状细胞癌中的作用
靶向FGFR
在移植瘤小鼠模型中,ICI联合FGFR抑制剂可增强抗肿瘤免疫效果,并延长生存。因此,成纤维细胞生长因子受体(FGFR)抑制剂联合ICI被作为ESCC患者的治疗新策略。2024 ASCO报道了一项开放标签、多中心、非随机、多队列的Ⅰb期研究中3个队列扩展阶段的更新结果,包括Futibatinib联合帕博利珠单抗治疗经过一线系统性治疗的晚期食管癌患者及Futibatinib联合帕博利珠单抗和化疗一线治疗晚期食管癌的耐受性和初步抗肿瘤疗效。该研究的队列A纳入的为经过一线系统性治疗的晚期食管癌患者(≥2线ICI初始),队列B纳入的为≥2线,ICI难治患者,队列D纳入的为1线初治患者。队列A和队列B方案均为Futibatinib联合帕博利珠单抗,队列D方案为Futibatinib联合帕博利珠单抗和FP化疗。队列A确认的ORR为42.9%(15/35),DCR为71.4%(15/35),mDoR为14.1个月,OS为11.9个月,PFS为5.8个月;在FGFRmRNA过表达阳性患者中ORR为39.3%(11/28),在阴性患者中为57.1%(4/7)。队列B确认的ORR为6.1%(3/49),DCR为51.0%(25/49),mDoR为6.0个月,OS为8.8个月,PFS为3.0个月。队列D确认的ORR为70.0%(14/20),DCR为70.0%(18/20),mDoR为6.5个月;在FGFR mRNA过表达阳性患者中ORR为70.6%(12/17),在阴性患者中为66.7%(2/3)。安全性方面,队列A常见的TRAEs分别为高磷血症(91.7%)、腹泻、口腔炎和指甲疾病(均为22.2%);队列B常见的TRAEs分别为高磷血症(80%)、口腔炎(20%)和腹泻(20%);队列D中最常见的治疗相关不良事件(≥3级)是中性粒细胞计数减少(57.1%)和贫血(23.8%),1名患者(3级口腔黏膜炎)观察到DLT。有2名患者死亡且因治疗相关不良事件(TRAE)而停药。该研究显示,Futibatinib联合帕博利珠单抗/化疗在一线晚期或转移性食管癌中显示出抗肿瘤活性,超过了一线帕博利珠单抗/化疗的历史疗效数据(ORR:70% vs. 45%(KEYNOTE 590 研究),Futibatinib联合帕博利珠单抗在未经免疫治疗的晚期食管癌患者后线中显示出令人鼓舞的疗效(ORR为43%),且无论FGFR mRNA是否过表达,都观察到了抗肿瘤活性。期待未来扩大样本量后的疗效及生存数据的结果。
TIGIT
新型检查点TIGIT抑制剂可通过补充PD-L1/PD-1通路进一步扩大免疫反应。2024年ASCO GI中一项国际多中心随机、双盲、安慰剂对照Ⅲ期临床试验(SKYSCRAPER-08)对比了Tiragolumab(TIGIT单抗)+阿替利珠单抗+化疗(紫杉醇175 mg/m2+顺铂60~80 mg/m2)和标准单纯化疗组一线治疗晚期ESCC的疗效和安全性。共有纳入461例患者,其中tiragolumab+阿替利珠单抗+CT有229例,安慰剂+CT为232例。截止到2022年6月15日,Tiragolumab+阿替利珠单抗组和单纯化疗组的中位PFS分别为6.2个月和5.4个月(HR=0.56;95%CI:0.45~0.70,P<0.0001),中位OS分别为15.7个月和11.1个月(HR=0.70;95%CI:0.55~0.88,P=0.0024),ORR分别为59.7%和45.5%,中位DoR分别为7.1个月和4.3个月。两组3~4级TRAE分别有59.6%和56.4%。研究结果显示:与化疗组相比,tiragolumab联合阿替利珠单抗+化疗带来了OS、PFS、ORR和DoR统计学显著提高和临床意义的改善,同时并没有增加安全风险。但这项研究的对照组为双安慰剂+化疗,tiragolumab联合阿替利珠单抗+化疗组的OS、PFS、ORR和DoR均未超越目前标准的单免+联合化疗的数据,这种“双免+化疗”模式能否超越单免+化疗的标准方案,哪些患者可以从这种加法模式中获益,需要对生物样本进行检测,为优势人群的筛选提供一定的参考。
双抗
双抗联合化疗也是晚期食管癌未来主要研究方向之一。一项Ⅱ期临床试验评估了PD-L1/TGF-βRII双功能融合蛋白SHR-1701联合化疗作为晚期食管鳞状细胞癌(ESCC)一线治疗的疗效和安全性,2025 ASCO-GI更新了其生存结果,研究共纳入24例患者,认的ORR为62.5%,DCR为87.5%。中位随访时间为20.8个月(95%CI:15.5~NR),中位缓解持续时间为9.1个月(95%CI:6.9~NR)。中位PFS为10.8个月(95%CI:7.8~NR),中位OS为26.1个月(95%CI:8.6~NR)。11例患者(45.8%)发生了3~4级治疗相关不良事件,未观察到治疗相关死亡。
卡度尼利单抗(Cadonilimab)作为全球首个获批的PD-1/CTLA-4双特异性抗体,通过双重免疫机制增强抗肿瘤效果,正成为肿瘤免疫治疗领域的一颗新星。一项卡度尼利单抗联合紫杉醇和顺铂作为晚期食管鳞状细胞癌(ESCC)一线治疗的有效性、安全性和DNA甲基化分析的开放标签多中心Ⅱ期试验(AK104-IIT-014)在2025 ASCO-GI更新其结果,研究共纳入43例患者,ORR为81.4%,DCR为97.7%。mPFS为7.10个月(95%CI:5.68~8.48),中位OS分析尚未成熟(图3)。3~4级TRAEs发生率为44.2%(19/43),主要包括中性粒细胞减少(25.6%)、白细胞减少(9.3%)和低钠血症(7.0%)。六个高甲基化的CpG位点,EPTIN9、PKNOX2、DLEU7、SOX7、CNRIP1和LINC00554可能是潜在的生物标志物,PR患者的平均治疗前甲基化水平显著高于非PR患者(P=7.8×10-7)。
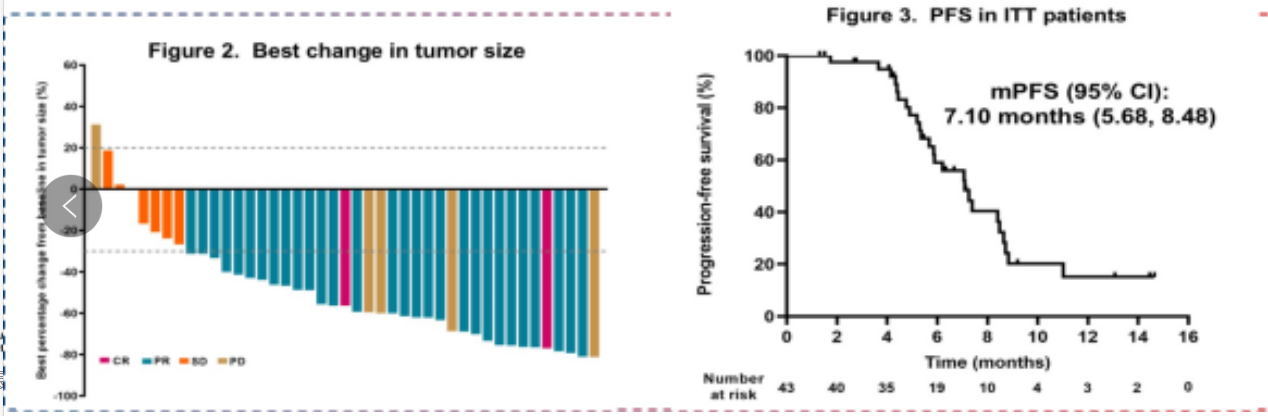
图3. AK104-IIT-014最新疗效数据
SHR-1701和卡度尼利单抗均同时抑制两个关键的免疫抑制通路,联合化疗治疗晚期一线ESCC取得了较高的ORR(卡度尼利单抗,81.4%)和较长的PFS(SHR-1701,10.8个月)和OS(SHR-1701,26.1个月),而不良反应谱与既往免疫治疗联合化疗的研究相似,未发现新的安全性信号。这种“双抗+化疗”模式在ESCC一线治疗能否在生存方面超越标准的免疫+化疗还需等待更大样本的Ⅲ期研究结果。
ADC
BL-B01D1是一种新型抗体药物偶联物(ADC),由靶向EGFR和HER3的双特异性抗体通过可裂解连接子与拓扑异构酶Ⅰ抑制剂(Ed-04)有效载荷偶联而成。由北京大学肿瘤医院沈琳教授牵头开展了一项BL-B01D1治疗晚期食管鳞癌的Ⅰ期临床研究,最新研究结果在Nat Med上发表。BL-B01D1剂量分别为2.0 mg/kg(N=22)和2.5 mg/kg(N=60)。所有患者的cORR为29.3%(24/82),在可评估疗效的患者中cORR为32.9%(24/73)。在2.5 mg/kg剂量组中,cORR达到39.6%(21/53),DCR为79.2%(42/53);而在2.0 mg/kg组中,cORR为15.0%(3/20),DCR为50.0%(10/20)。在2.5 mg/kg组中,治疗相关3级及以上不良事件发生率为63.3%,最常见的包括贫血(28.3%)、白细胞减少(18.3%)、血小板减少(18.3%)和中性粒细胞减少(16.7%)。观察到两例≥3级的间质性肺病事件。基于疗效与安全性综合评估,推荐的2期剂量确定为2.5 mg/kg,采用Q3W第1天和第8天给药方案。总体而言,BL-B01D1在转移性食管鳞状细胞癌患者中表现出良好的抗肿瘤活性及可控的安全性特征。BL-B01D1单药治疗对比医生选择的化疗二线治疗晚期ESCC的Ⅲ期研究正在进行中(NCT06304974)。
B7-H3,又名CD276,是一种I型跨膜蛋白,是B7免疫共刺激和共抑制家族中重要的一员,近年来,越来越多的证据表明B7-H3为共抑制受体,通过对T细胞的抑制作用,在肿瘤免疫逃逸中发挥作用。MHB088C是一种靶向B7H3的在研抗体-药物偶合物,由人源化抗B7H3单克隆抗体与高效DNA拓扑异构酶Ⅰ抑制剂偶联而成。2024 ASCO报道了一项Ⅰ/Ⅱ期研究,探索了MHB088C治疗复发或转移性实体瘤患者的安全性和有效性。数据截止日期为2023年12月31日,共60例患者入组并至少接受了1剂MHB088C治疗,其剂量限制性毒性(DLT)包括血小板计数下降和发热性中性粒细胞减少症。该研究剂量爬坡阶段探索了0.8 mg/kg-4.0 mg/kg剂量组的抗肿瘤活性;总体ORR33.7%;在入组的所有患者中,共7例ESCC患者,6例患者出现了肿瘤退缩,3例达到PR;ORR近40%,有望成为食管癌中新的治疗方式;而B7H3表达情况与疗效的关系尚需后续探索。
Nectin-4是一种粘附分子,在多种实体瘤尤其是尿路上皮癌、宫颈癌、食管癌和乳腺癌中高度表达。9MW2821是一种抗体偶联药物,能够将毒素MMAE递送至表达Nectin-4的细胞。2024 ASCO报告了Nectin-4 ADC创新药(9MW2821)用于多项晚期实体瘤的Ⅰ/Ⅱ期临床研究结果(图4)。39例可评估疗效的食管癌患者中,ORR和DCR分别为23.1%和69.2%,mPFS为3.9个月,mOS为8.2个月;其中37例接受过铂类化疗及免疫治疗。其剂量限制性毒性4级中性粒细胞减少。数据显示,9MW2821在晚期食管癌患者中现了令人鼓舞的疗效。其在安全性方面也显示出了充足的耐受性。
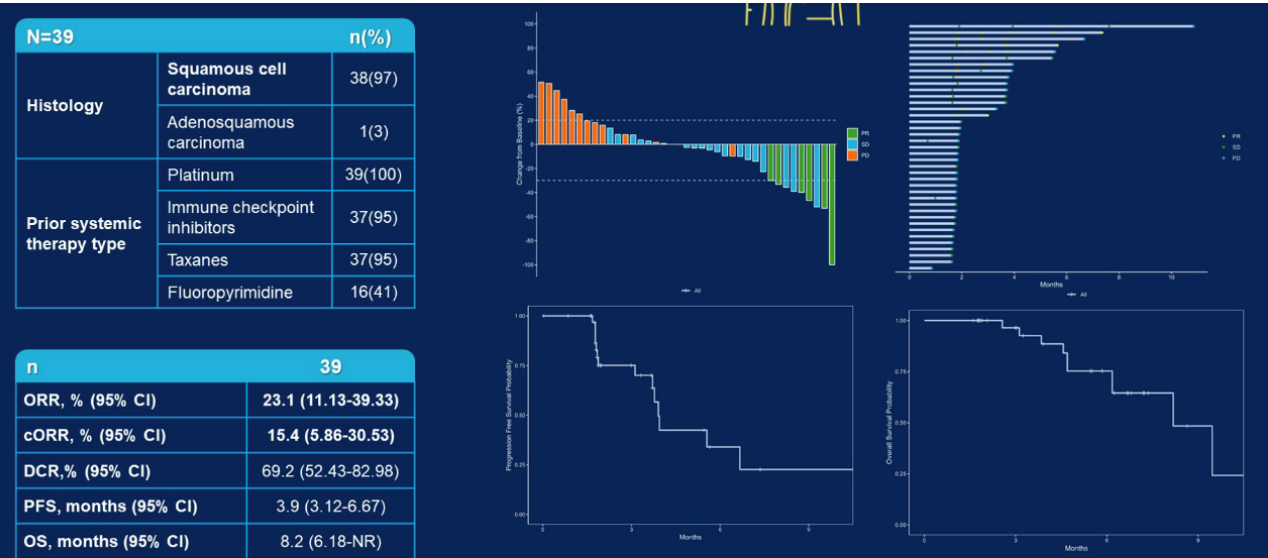
图4. Nectin-4 ADC治疗标准治疗失败的实体瘤的Ⅰ/ⅡA期临床研究
其他
其他免疫联合方案用于晚期食管癌治疗的探索方面包括表观遗传学等,西达本胺+免疫+安罗替尼正在晚期食管癌中进行探索。另外,MUC1靶向CAR-T细胞联合PD-1敲除的独特免疫治疗用于晚期食管癌患者的初步结果披露,新的免疫治疗模式正在进行中。
- 推荐文章
