- 首页 > 正文
Nature Medicine丨AI赋能结直肠癌手术:个性化围手术期治疗的临床突破与未来方向
发表时间:2026-01-30 17:59:04
编者按 在全球范围内,结直肠癌是发病率与死亡率均位居前列的恶性肿瘤,而手术仍是根治性治疗的核心手段。然而,择期结直肠癌手术后的不良结局——包括严重并发症、死亡及由此引发的生存率下降、医疗成本激增——长期困扰着临床实践。传统的风险评估工具往往依赖单一维度(如年龄、合并症数量),难以全面捕捉患者个体差异,导致高风险患者错失精准干预,低风险患者面临过度医疗。在此背景下,人工智能(AI)凭借处理海量数据、挖掘复杂关联的能力,为解决这一困境提供了新可能。但此前多数AI预测模型停留在实验室阶段,如何跨越“研究到临床”的鸿沟,成为其转化价值的关键。
一、研究设计:从数据到临床的“四步走”策略
为确保模型的可靠性与临床适用性,研究采用了“问题探索-模型开发-临床验证-效果评估”的渐进式设计,核心数据与队列构建极具代表性:
1.数据基础:全国性注册数据与临床真实世界数据结合
模型开发的核心数据来源于丹麦四大全国性医疗注册数据库,涵盖18 403例2014~2019年接受择期根治性结直肠癌手术的患者(全国注册队列,NRC)。这些数据包含患者的合并症、肿瘤分期、实验室指标、用药史等多维度信息,为捕捉风险因素的复杂关联提供了充足样本。
后续验证与对比则依赖单中心数据:回顾性临床队列(RCC)纳入806例2020~2022年手术患者,用于模型外部验证;前瞻性临床队列(PCC)纳入194例2023年手术患者,作为AI指导下个性化围手术治疗的干预组,直接对比标准护理的效果。
2.模型开发:从“海量变量”到“精准预测”
研究初期筛选出8694个潜在风险变量(如年龄、Charlson合并症指数、WHO功能状态、肿瘤UICC分期等),通过“数据驱动+临床监督”的混合筛选策略,最终保留58个关键变量纳入模型。采用一种可自动筛选重要变量的统计方法——LASSO逻辑回归算法,构建1年死亡率预测模型,并通过以下指标验证性能:
• 区分能力:外部验证集中的受试者工作特征曲线下面积(AUROC)达0.79,意味着模型能较好区分高风险与低风险患者; • 校准度:低风险区间(预测1年死亡率<10%)的实际事件率与预测风险高度吻合,仅高风险区间(>10%)存在轻微高估,且这种高估在临床可接受范围内(避免低风险患者漏判); • 稳定性:Brier评分(衡量预测误差)在开发集、内部验证集、外部验证集中分别为0.043、0.046、0.044,数值极低,表明模型预测精度稳定。
3.风险分组与个性化治疗路径
基于模型预测的1年死亡率风险,研究将患者分为4个等级,干预强度随风险递增:
• A组(≤1%):低风险,常规围手术期护理; • B组(1%~5%):中低风险,增加基础营养评估与轻度功能锻炼; • C组(5%~15%):中高风险,强化术前贫血纠正(静脉补铁)、营养师干预、监督式康复训练; • D组(>15%):高风险,除上述措施外,额外增加术中目标导向血流动力学监测、术后24小时重症监护、个体化疼痛管理与谵妄筛查。
二、核心结果:临床获益与经济价值双重凸显
研究通过对比AI个性化围手术治疗组(PCC)与标准护理组(RCC)的结局,证实了AI模型的实用价值,核心结果可概括为三大维度:
1.术后并发症显著减少
• 综合并发症指数(CCI):PCC中CCI>20的发生比例为19.1%,而RCC为28%(图1左)。单因素逻辑回归分析显示,个性化围手术期治疗相较于标准治疗,CCI>20的比值比显著降低(OR=0.60;95%CI:0.40~0.88;P=0.011)。此外,风险组C和D相较于风险组A,CCI>20的比值比显著升高(OR=1.76;95%CI:1.12~2.81;P=0.015和OR=2.53;95%CI:1.47~4.38;P<0.001)。在多因素逻辑回归中调整风险组后,个性化围手术期治疗相较于标准治疗的关联性仍存在(图1右)。 • 术后医疗并发症:在PCC组中,医疗并发症的发病率为23.7%,而RCC组为37.3%(图1b左)。单变量逻辑回归分析显示,与个性化围手术期治疗相比,标准护理组的医疗并发症发生比值显著更高(OR=0.52;95%CI:0.36~0.74;P<0.001)。此外,与风险组A相比,风险组C和D的医疗并发症发生比值更高(OR分别为2.36;95%CI:1.53~3.70;P<0.001和3.34;95%CI:1.98~5.71;P<0.001)。在调整风险组后,多变量逻辑回归分析仍显示个性化围手术期治疗与标准护理之间存在类似关联(OR=0.53;95%CI:0.36~0.76;P<0.001,图1b右)。 • 术后并发症计数:术后90天内的并发症发生率(IR)在PCC组为0.48次,RCC组为0.76次;图1c左)展示了术后前90天内的平均并发症数量。单变量负二项回归模型显示,个性化围手术期治疗的并发症发生率低于对照组(发生率比IRR=0.63;95%CI:0.48~0.83;P=0.001)。与风险组A相比,风险组C和D的并发症发生率更高(IRR分别为1.97;95%CI:1.42~2.75;P<0.001和2.63;95%CI:1.80~3.88;P<0.001)。在调整风险组的多变量负二项回归中,个性化围手术期治疗与标准护理之间仍存在类似关联(IRR=0.66;95%CI:0.50~0.87;P=0.003),结果见于图1c右。 • 再入院率:在术后前90天内,PCC组患者平均再入院次数为0.2次,而RCC组同期为0.31次(图1d左)。单变量负二项回归模型显示,个性化围手术期治疗与再入院次数存在统计学显著关联(发生率比IRR=0.64;95%CI:0.43~0.95;P=0.028)。在多变量负二项回归中控制风险组后,个性化围手术期治疗与标准护理相比仍呈现相似关联(IRR=0.66;95%CI:0.44~0.98;P=0.041,图1d右)。
值得注意的是,高风险组(C、D组)的获益更为显著——这表明AI模型成功识别出最需要干预的人群,实现了“精准发力”。
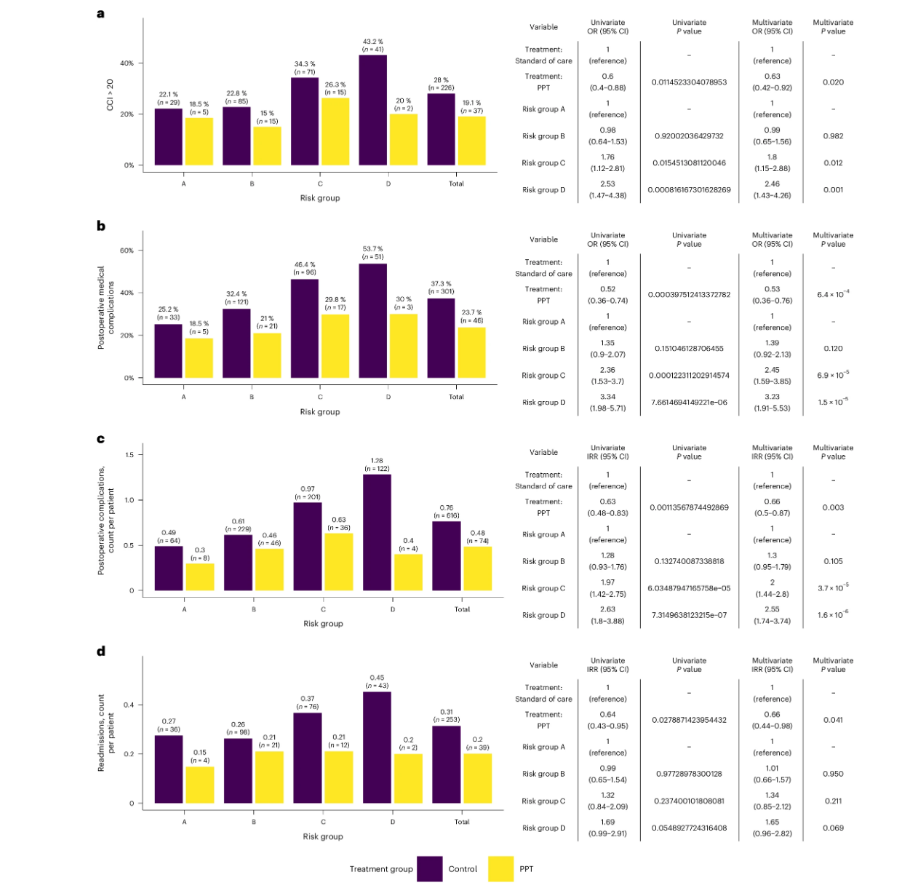
图1. 研究临床结果
2.成本效益优势明确
通过1年时间跨度的卫生经济学模型(混合决策树与马尔可夫模型)分析,个性化围手术期治疗组的人均医疗成本为25 159美元,较标准护理组(28 007美元)节省2848美元;同时,患者的质量调整生命年(QALYs,衡量健康效益)增加0.02。敏感性分析显示,在96.56%的模拟场景中,个性化治疗均实现“成本降低+健康获益”,证明其在经济上的可持续性。
3.临床落地可行性高
模型的临床整合并未依赖复杂的IT改造:通过丹麦国家生命科学超级计算中心的安全私有云部署,外科医生仅需通过多因素认证登录系统,手动录入患者电子健康记录(EHR)中的关键信息,即可获得风险分组结果;且临床医生与AI的风险分组一致性高达κ=0.926,仅4.6%的病例需根据临床判断微调,体现了模型与临床实践的兼容性。
三、突破与挑战:AI外科决策的“落地启示”
该研究的核心突破在于解决了此前AI医疗模型的“落地痛点”,同时也为未来研究指明了方向:
1.关键创新:多学科协作与标准化框架
• 临床主导的模型开发:不同于纯数据驱动的AI模型,该研究全程有结直肠外科医生、麻醉科医生、流行病学家参与,确保筛选的风险变量(如术前贫血、功能状态)符合临床实际需求,避免“模型性能优秀但临床无用”的困境;
• 标准化数据格式:采用OMOP通用数据模型整合不同来源的注册数据,解决了医疗数据“孤岛化”问题,为模型在其他医院或地区的推广奠定基础;
• 风险分层的实用性:将预测结果转化为4个简单的风险等级,而非复杂的概率数值,降低了临床医生的使用门槛,这是模型能快速落地的关键。
2.现存局限与未来方向
尽管成果显著,研究仍存在不足:
四、总结:AI推动结直肠癌外科进入“精准围手术期”时代
这项研究不仅为结直肠癌手术患者带来了切实获益,更为AI在外科领域的转化应用提供了可复制的框架:以真实世界数据为基础、以临床需求为导向、以多学科协作为支撑,才能让AI从“实验室工具”变为“临床助手”。
未来,随着数据共享机制的完善、模型可解释性的提升,这类AI决策工具有望扩展至胃癌、肝癌等其他外科领域,最终推动整个围手术期管理从“经验驱动”向“数据驱动”转型——这不仅能改善患者预后,更能优化医疗资源配置,为应对全球医疗负担提供新解法。
参考文献
[1] Rosen,A.W.,Ose,I.,Gögenur,M. etal. ClinicalimplementationofanAI-basedpredictionmodelfordecisionsupportforpatientsundergoingcolorectalcancersurgery. NatMed (2025).- 推荐文章
