- 首页 > 正文
2025 ESMO速递丨胰腺癌新药研究取得突破,生物标志物指导PDAC个性化治疗
发表时间:2026-02-04 21:56:44
由于缺少有效的筛查手段和早期诊断方法,仅15%~20%的胰腺导管腺癌(PDAC)患者确诊时可接受根治性手术治疗,大多数为局部晚期及转移性PDAC,药物治疗是其主要治疗手段。由于PDAC药物治疗进展缓慢,胰腺导管腺癌(PDAC)是生存率最低的恶性肿瘤之一,个体化用药需求尤为迫切。作为全球肿瘤学领域的顶尖盛会,2025年欧洲肿瘤内科学会(ESMO 2025)发表了多项即将改变临床实践的重磅研究。今天我们为大家分享胰腺癌新药研究方面的进展。
2216MO - VIRAGE试验:一项随机、Ⅱb期、开放标签研究,旨在评估纳米白蛋白结合型紫杉醇联合吉西他滨±静脉注射VCN-01治疗转移性胰腺癌(mPDAC)患者的疗效
背景
VCN-01是一种溶瘤腺病毒,其可表达透明质酸酶以降解肿瘤间质、促进化疗并增强抗肿瘤免疫反应。基于该药物良好的安全性特征及与标准治疗方案(SoC)吉西他滨/白蛋白结合型紫杉醇(GA)联用时显示出的积极疗效,我们开展了一项开放标签、对照、随机化的Ⅱb期临床试验,旨在评估两种剂量的VCN-01联合GA治疗转移性胰腺导管腺癌(mPDAC)的有效性和安全性。
方法
初治的mPDAC患者按1:1比例随机分组:一组接受重复28天周期中第1、8、15天的SoC剂量GA治疗(组1);另一组在GA第1周期和第4周期开始前各接受一次静脉注射VCN-01(剂量为1×1013?vp/次)(组2)。主要终点指标为总生存期(OS)和安全性。试验设计效力为80%,旨在通过双侧α=0.1检测mITT或FAS人群中的OS差异。次要目标包括无进展生存期(PFS)、缓解率、缓解持续时间(DoR)及生物标志物CA19.9水平。
结果
共入组112例患者。mITT人群定义为至少接受过1次GA治疗(组1)或VCN-01治疗(组2)的患者;FAS人群定义为至少接受过1次GA治疗(组1)或先接受VCN-01后至少接受1次GA治疗(组2)的患者。
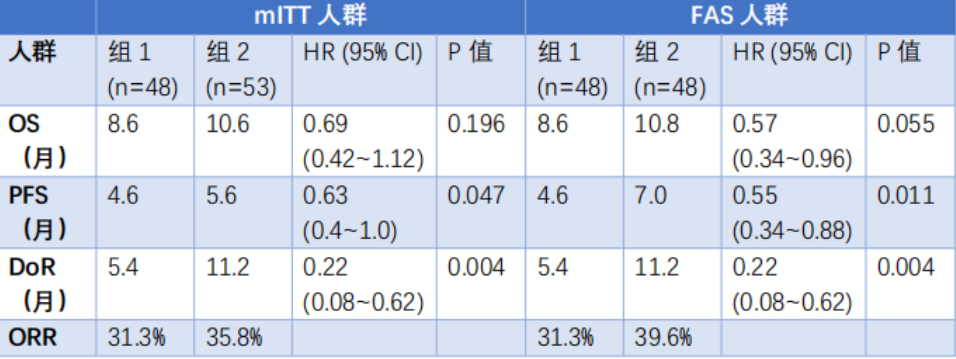
与单独开始GA第4周期的患者(组1)相比,接受两剂VCN-01后进入GA第4周期的患者(组2)表现出更显著的生存获益:OS延长至14.8个月?vs.?11.6个月(HR=0.44;95% CI 0.21~0.92;P=0.046),PFS延长至11.2个月?vs.?7.4个月(HR=0.48;95% CI 0.25~0.91;P=0.017)。VCN-01给药耐受性良好,所有相关严重不良事件(N=13)均已缓解,最常见事件包括流感样症状(13.2%)、转氨酶升高(5.7%)和药物性肝损伤(3.8%)。病毒基因组分析证实了第二剂VCN-01的生物活性。
结论
本研究达到主要终点。与单纯GA标准治疗相比,接受VCN-01+GA联合治疗的患者总生存期、无进展生存期和缓解持续时间均获得改善。
2214MO - Ⅰ期篮式研究:靶向c-Met蛋白的抗体偶联药物telisotuzumab adizutecan(ABBV-400;Temab-A)——来自胰腺导管腺癌(PDAC)患者的研究结果
背景
c-Met(MET)蛋白在多种肿瘤类型中均有表达,包括胰腺导管腺癌(PDAC),且与肿瘤进展、转移及治疗耐药性相关。Temab-A由靶向c-Met蛋白的抗体与拓扑异构酶1抑制剂偶联而成。评估Temab-A用于实体瘤的Ⅰ期研究的初步数据显示其具有抗肿瘤活性和可控的安全性特征。本文报告了该药物在PDAC中的疗效与安全性数据。
方法
这项Ⅰ期、开放标签的篮式研究(NCT06084481)纳入年龄≥18岁、患有晚期/转移性PDAC(依据RECIST v1.1标准)、ECOG体力状态评分≤1且在接受一线全身治疗后或期间出现疾病进展的患者。受试者每3周接受一次2.4或3.0 mg/kg剂量的Temab-A治疗。研究目标包括安全性与有效性评估。
结果
截至2024年11月6日,共有42例PDAC患者接受Temab-A治疗;中位年龄为69岁(范围45~86岁);男性占比57%。既往接受过中位1线(范围1~3线)全身治疗。总体人群的确认客观缓解率(ORR)为24%,其中接受一线吉西他滨联合白蛋白紫杉醇治疗的患者ORR达40%。数据截止时,持续缓解持续时间(DOR)和总生存期(OS)尚未成熟。疗效详见下表。所有患者均发生任何级别的治疗期间不良事件(TEAE),最常见包括恶心(52%)、贫血(50%)、食欲减退(48%)、中性粒细胞减少症(43%)、乏力(38%)和呕吐(33%);≥3级TEAE发生率≥10%的事件为贫血(38%)和中性粒细胞减少症(21%)。经裁定的间质性肺病/肺炎发生率为4.8%。因TEAE/治疗相关不良事件(TRAE)导致停药的比例分别为26%/14%,剂量中断率为62%/41%,剂量下调率为43%/43%。TEAE导致5例死亡(占12%),其中2例由疾病进展引起,无病例与Temab-A相关。免疫组化检测显示98%的样本中c-Met蛋白表达水平≥90%且强度≥1+。目前正开展生物标志物分析以明确c-Met蛋白表达与治疗反应之间的关联性。
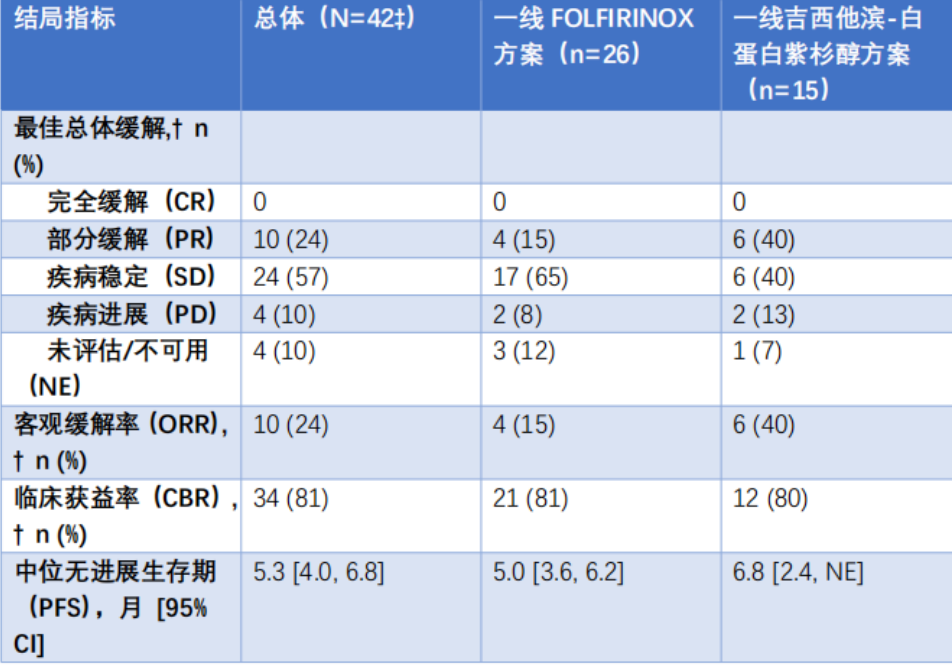
注:?4例数据不全的患者。?1例患者接受了其他化疗方案。
结论
Temab-A在晚期PDAC患者中表现出可控的安全性特征和有前景的疗效,尤其在接受一线吉西他滨联合白蛋白紫杉醇治疗的患者中效果显著。
小结
胰腺导管腺癌(PDAC)是全球第七大癌症死亡原因,手术是PDAC目前唯一的治愈性疗法。然而,尽管进行了手术,近90%的患者都会在中位7~9个月内复发,5年总生存率(OS)仅为8~10% 。尽管辅助性多药化疗可以延缓复发,并且是手术切除PDAC的标准疗法,但大多数患者还是会在14个月左右复发,5年OS率<30%。近年来,研究者在PDAC的靶向治疗、免疫治疗和生物治疗领域进行了一系列探索,旨在进一步改善患者的预后。
开放标签、对照、随机化的Ⅱb期临床试验VIRAGE探索了溶瘤病毒(VCN-01)联合化疗的免疫调节潜力,研究表明与单纯GA标准治疗相比,接受VCN-01+GA联合治疗的患者总生存期、无进展生存期和缓解持续时间均获得改善。PDAC目前缺乏有效靶向药物,c-Met作为驱动基因(在约20%~30% PDAC中过表达),Temab-A为这部分患者提供了新的治疗选择。ADC技术通过细胞毒载荷(如拓扑异构酶抑制剂)可能克服传统小分子c-Met抑制剂的耐药性。这项Ⅰ期、开放标签的篮式研究表明Temab-A在晚期PDAC患者中表现出可控的安全性特征和有前景的疗效,尤其在接受一线吉西他滨联合白蛋白紫杉醇治疗的患者中效果显著。
Temab-A代表靶向治疗的进步,为c-Met阳性PDAC患者带来新希望,但需严格筛选人群;VIRAGE试验则凸显免疫治疗在PDAC中的挑战,溶瘤病毒需进一步优化以克服微环境抑制。两项研究均推动PDAC的个体化治疗,强调生物标志物驱动和联合策略的重要性。
- 推荐文章
