- 首页 > 正文
食管鳞癌新辅助治疗迎来新突破!化免方案VS放化疗,生存、复发数据全面对比
发表时间:2026-01-30 17:36:09
食管癌是我国高发的恶性肿瘤之一,其中食管鳞状细胞癌(ESCC)占比极高,局部晚期患者的治疗一直是临床关注的重点。新辅助治疗作为局部晚期ESCC的关键治疗环节,近年来随着免疫治疗的兴起,治疗模式不断迭代。ESCC新辅助化免治疗(NCIT)与新辅助放化疗(NCRT)对照研究,为临床治疗决策提供了极具价值的循证依据。本文将详细解读核心研究数据,带您洞悉ESCC新辅助治疗的最新进展。
一、研究背景:免疫治疗改写ESCC新辅助治疗格局
二、核心研究解读:NCIT与NCRT的疗效、安全性全面PK
当前已有多项高质量研究数据从多个维度(病理缓解、术后并发症、生存情况及复发模式等)对NCIT与NCRT的疗效、安全性进行了全面比较,以下为核心研究的详细分析:
一 李志刚教授团队发表于JAMA Surg的研究(2025):532例匹配患者的头对头对比[1]
该研究采用倾向评分匹配(PSM)方法,最终纳入NCIT组与NCRT组各532例患者,基线特征(除术后辅助治疗外)均衡可比,为结果的可靠性奠定基础。
1 病理评估:MPR率NCRT更优,pCR率无显著差异
病理缓解是评估新辅助治疗效果的重要指标,直接反映肿瘤对治疗的反应程度。病理完全缓解率(pCR)两组表现相近,NCIT组为22.9%,NCRT组为25.9%,差异无统计学意义(P=0.25),意味着两种方案使肿瘤完全消退的能力相当。主要病理缓解率(MPR)方面,NCRT组显著更优,分别为71.8% vs. 61.5%(P<0.001)。进一步分析肿瘤退缩分级(TRG)发现,两组TRG 1(完全缓解)比例相近(NCIT 32.9% vs. NCRT 34.0%),但NCRT组TRG 2(残留肿瘤<10%)比例更高(37.8% vs. 28.6%),这是其MPR率更优的主要原因。此外,两组淋巴结阴性率(ypN0)基本一致,NCIT组为56.4%,NCRT组为55.1%,提示在控制区域淋巴结转移方面,两种方案效果相当。
2 术后并发症:肺炎、胸腔积液NCIT更常见,喉返神经麻痹NCRT风险高
术后并发症直接影响患者恢复及生活质量,两组在不同并发症类型上呈现差异化风险。总体并发症率NCRT组为42.3%,NCIT组为37.6%,整体安全性均可控。对于特定高风险并发症,如肺炎,NCIT组发生率显著高于NCRT组(22.7% vs. 12.2%,P<0.001),需临床加强肺部感染预防与监测;胸腔积液(需引流)NCIT组更常见(19.6% vs. 9.0%,P<0.001),术后需关注胸腔情况,及时处理积液;喉返神经麻痹NCRT组发生率更高(19.9% vs. 15.2%,P=0.03),可能与放疗对神经的损伤相关。
但是其他并发症方面,无显著差异。心脏并发症(NCIT 3.8% vs. NCRT 2.4%)、吻合口瘘(8.5% vs. 8.7%)等关键并发症发生率相近,未出现某一方案明显劣势的情况。
3 生存与复发:NCIT生存优势显著,远处转移风险大幅降低
生存获益是评价治疗方案的核心指标,该研究中NCIT组展现出明显优势。2年总体生存率(OS),NCIT组以81.3%显著高于NCRT组的71.3%(HR=1.57,95%CI:1.26~1.96,P<0.001,图1B),意味着接受NCIT治疗的患者2年内存活概率更高。
2年无病生存率(DFS),NCIT组同样更优(73.9% vs. 63.4%,HR=1.37,95%CI:1.11~1.69,P<0.001,图1A),在预防疾病复发或进展方面表现更出色。
此外,亚组分析显示,无论患者是否达到MPR或非pCR,NCIT组的生存均优于NCRT组(图1C、D);但在达到pCR的患者中,两组生存无显著差异,提示pCR可能是预后良好的重要标志,一旦达到pCR,不同方案对生存的影响减弱。
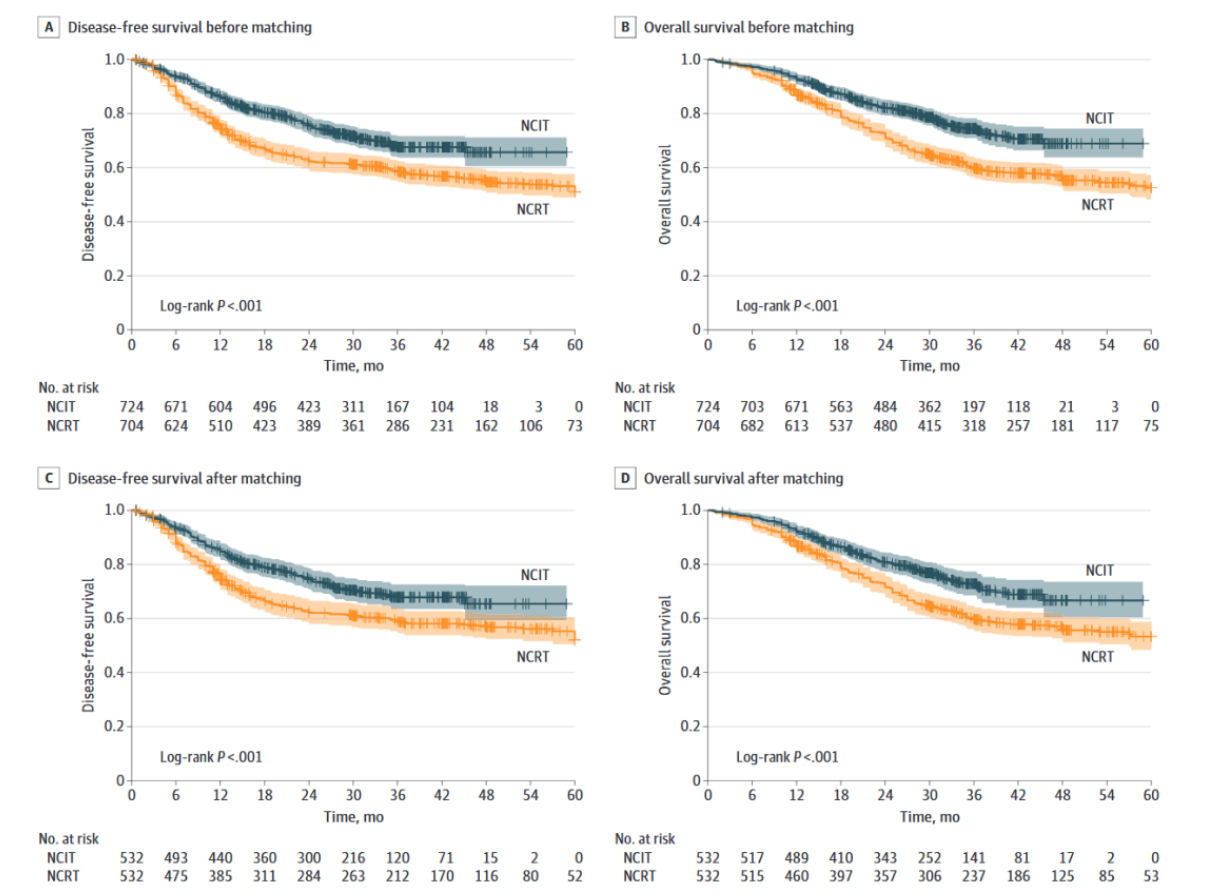
图1. 研究生存数据
复发部位与类型直接影响后续治疗策略,两组复发特征差异明显。局部复发(LR),两组无显著差异(NCIT 18.4% vs. NCRT 20.9%,P=0.23,图2C),包括区域淋巴结复发、吻合口复发等亚型,提示两种方案在控制局部病灶方面效果相当。2年总体复发率,NCIT组显著低于NCRT组(23.7% vs. 35.7%,P<0.001,图2D)。 NCIT组远处转移率明显更低(13.5% vs. 25.0%,P<0.001),尤其在骨转移(2.8% vs. 8.5%)和肺转移(4.9% vs. 11.3%)方面差异显著,这是其生存优势的重要原因。
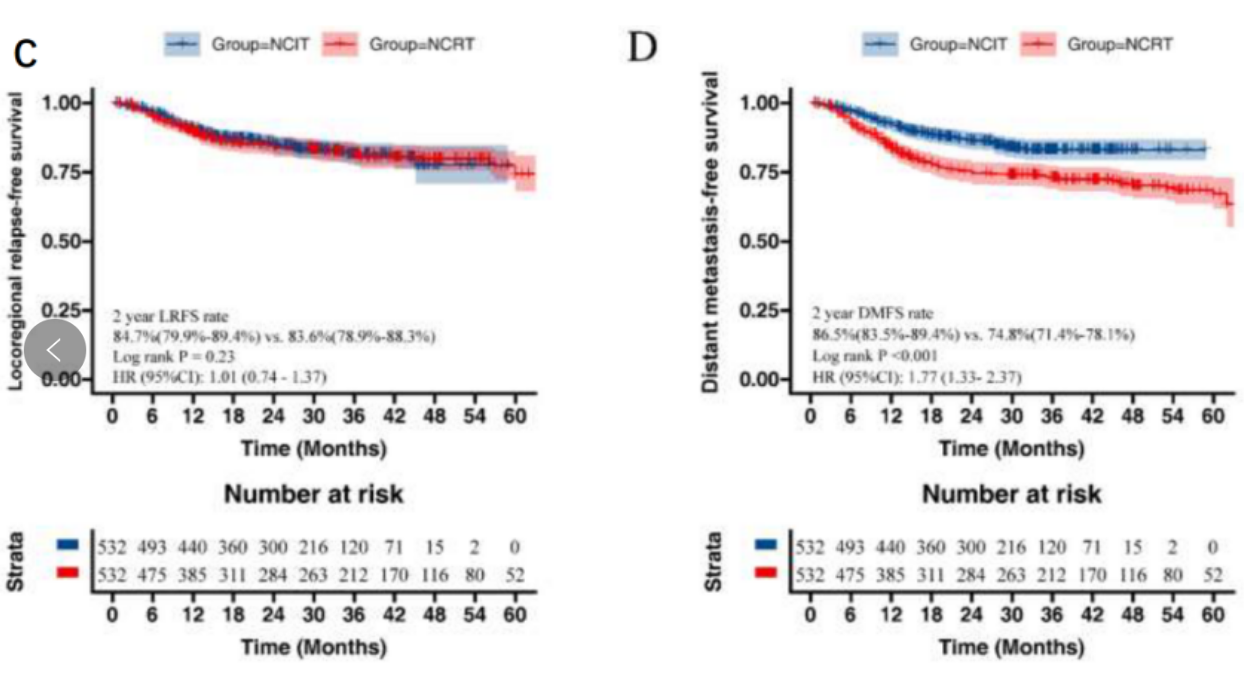
图2. 两组复发率
二 其他关键研究:NCIT生存优势再验证,放化免方案pCR率亮眼
除上述核心研究外,谭黎杰教授、李印教授及冷雪峰教授团队的研究结果,进一步丰富了临床证据。
1 谭黎杰教授团队研究[2]:DFS优势显
该研究纳入CRT(放化疗)组与ICT(化免治疗)组各124例患者,结果显示, pCR率CRT组29% vs. ICT组20.2%(P=0.14),无显著差异;2年OS,ICT组86.8% vs. CRT组80.2%(P=0.094),虽未达统计学显著,但呈现更优趋势;2年DFS,ICT组85.8% vs. CRT组77.6%(P=0.002),差异显著,再次验证NCIT在预防疾病进展方面的优势。
2 李印教授团队研究[3]:3年OS优势明确
研究纳入CRT组121例、ICT组81例患者,长期随访结果显示,pCR率,CRT组36.2% vs. ICT组27.5%(P=0.239),无显著差异;3年OS,ICT组91.7% vs. CRT组79.8%(P=0.032);3年DFS,ICT组87.4% vs. CRT组72.8%(P=0.039),均达统计学显著,为NCIT的长期获益提供证据。
3 冷雪峰教授团队研究[4]:放化免方案pCR率最高
该研究探索了三种方案的疗效(A组:信迪利单抗+nab-PC;B组:信迪利单抗+nab-PC+放疗;C组:nab-PC+放疗),结果显示,pCR率,B组(放化免)以60%显著高于A组(13%,P<0.0001)和C组(47.3%,P<0.0001);C组pCR率也显著高于A组(47.3% vs. 13%,P=0.0005),提示放疗联合化免可能进一步提升肿瘤退缩效果,但需关注其安全性,为后续研究提供新方向。
三 462例患者IPTW校正研究:NCIT远处转移优势再强化
另一项纳入462例患者(NCIT组232例、NCRT组230例)的研究,采用倾向评分加权(IPTW)校正基线资料,结果与前述研究高度一致。pCR率,IPTW调整后两组相近(33.6% vs. 41.0%);3年OS方面,NCIT组79.7% vs. NCRT组68.2%(P=0.023,图3),优势显著;术后2年远处转移率,NCIT组仅1.7%,远低于NCRT组的15.3%(P<0.001),且在颈部淋巴结、肺、肝、大脑转移等亚型上差异均显著,进一步证实NCIT对远处转移的强效控制。
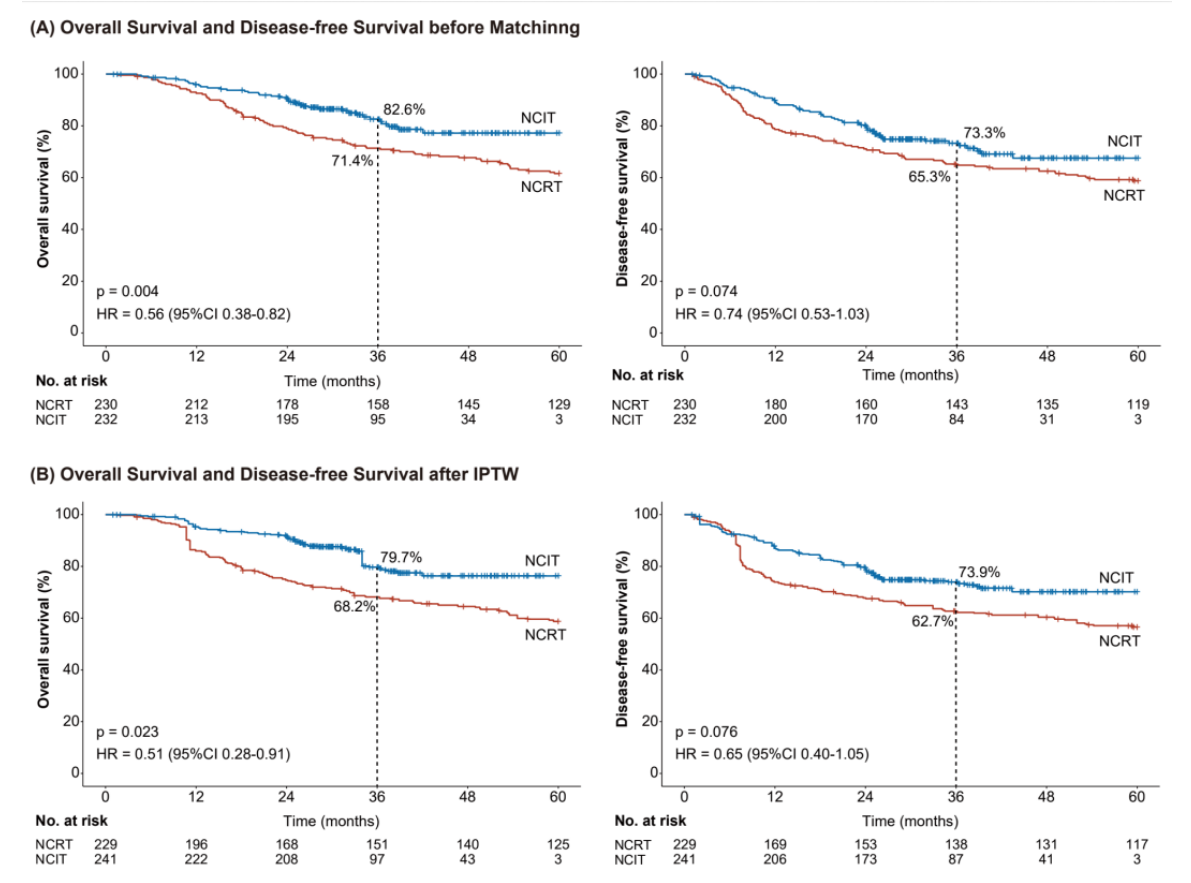
图3. IPTW校正前后患者生存数据
三、结论与临床启示:NCIT成优选,个体化决策是关键
综合所有研究数据,我们不难得出结论:对于局部晚期ESCC,新辅助化免治疗(NCIT)相较于新辅助放化疗(NCRT),具有生存优势显著、远处转移更少的特点,且围术期严重并发症(如吻合口瘘、死亡率)发生率相似,总体安全性可接受,为局部晚期ESCC患者提供了更优的治疗选择。
同时,上述研究也指出了临床实践中的关键启示。首先,方案选择需个体化。虽然NCIT整体优势明显,但NCRT远期数据更成熟,且部分患者(如肿瘤负荷较高、局部侵犯严重者)可能更适合NCRT。临床需结合患者年龄、身体状况、肿瘤分期、生物标志物(如PD-L1表达、TMB等)等因素,通过多学科团队(MDT)讨论制定方案。其次,需要关注功能保留与生活质量。未来研究需进一步探索在保证疗效的同时,如何减少治疗相关副作用(如NCIT相关肺炎、NCRT相关喉返神经损伤),提升患者生活质量。最后,放化免方案前景广阔。冷雪峰教授团队研究显示放化免方案pCR率最高,提示该方案可能为部分患者带来更强的肿瘤控制效果,但需开展更多研究验证其长期生存获益及安全性。
总之,随着免疫治疗在食管癌领域的深入应用,新辅助化免治疗已成为局部晚期ESCC的重要治疗方向。傅剑华教授团队及国内专家的多项研究,为NCIT的疗效与安全性提供了坚实证据,未来有望进一步改写临床指南,让更多患者受益。在精准医学时代,结合患者个体特征与多学科协作,将是实现食管癌个体化治疗、提升患者生存获益的关键。
参考文献
[1]Guo X et al. Neoadjuvant chemoradiotherapy vs chemoimmunotherapy for esophageal squamous cell carcinoma. JAMA Surg. Published online March 19, 2025. doi:10.1001/jamasurg.2025.0220
[2]Lijie Tan, et al. Perioperative Outcomes and Survival after Neoadjuvant Immunochemotherapy for Locally Advanced Esophageal Squamous Cell Carcinoma. https://doi.org/10.1016/j.jtcvs.2024.06.020
[3]Yin Li, et al.Neoadjuvant chemotherapy combinedwith immunotherapy versus neoadjuvant chemoradiotherapy in patients with locally advanced esophageal squamous cell carcinoma.The Journal of Thoracic and Cardiovascular Surgery c Volume
- 推荐文章
