- 首页 > 正文
Jeeyun Lee教授解析多组学技术如何重塑胃癌免疫微环境丨2025韩国国际胃癌周
发表时间:2026-01-30 23:16:56
编者按
胃癌作为全球高发且难治性的恶性肿瘤之一,其治疗面临巨大挑战。近年来,随着对肿瘤微环境、免疫应答机制及分子分型的深入理解,基于生物标志物的精准医疗成为改善患者预后的关键方向。韩国成均馆大学医学院的Jeeyun Lee教授在韩国国际胃癌周(KINGCA WEEK 2025)上发表了最新研究成果,系统综述了多组学技术在解析胃癌异质性、预测免疫检查点抑制剂(ICB)疗效以及开发新型联合疗法方面的突破性进展,重点讨论了肿瘤突变负荷(TMB)、微卫星不稳定性(MSI)、Claudin18.2表达等关键生物标志物的临床价值,并分析了T细胞受体(TCR)克隆动态、空间转录组学和蛋白质组学如何揭示免疫逃逸机制。

一、分子标志物的发展为胃癌靶向治疗带来新突破
胃癌作为全球范围内高发的恶性肿瘤之一,其治疗一直面临巨大挑战。随着对胃癌分子机制的深入了解,以及生物技术的快速发展,胃癌治疗正逐步从传统的化疗向精准医疗转变。近年来,胃癌领域新药层出不穷,为晚期胃癌患者提供了多种治疗选择(图1)。
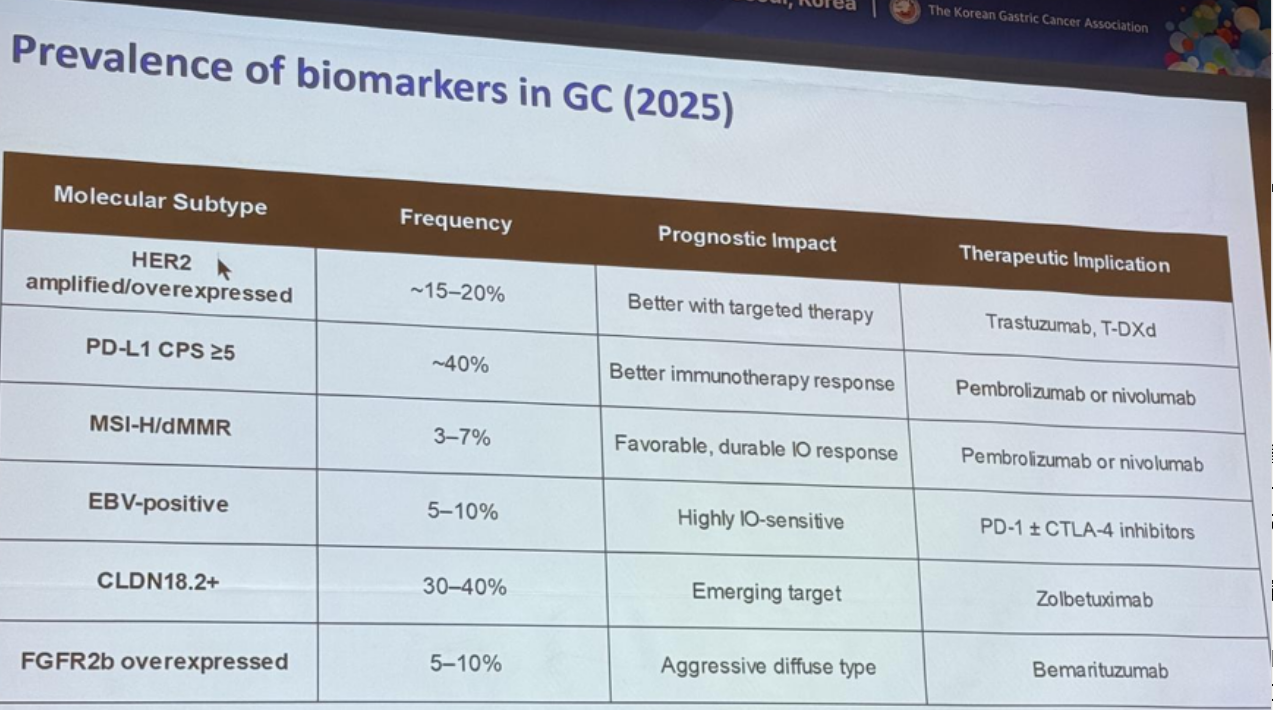 图1. 胃癌常见分子标志物及治疗选择
图1. 胃癌常见分子标志物及治疗选择
二、平台试验的优势与挑战
自2014年起实施的双轨制试验体系包括常规赞助研究和深度探索性平台研究两部分。前者采用传统设计验证标准方案有效性,后者则允许动态调整入组标准以纳入难治性人群。例如,在伞式试验框架下,研究者根据实时生物标志物反馈将患者分配至不同治疗臂(如MEK抑制剂Selumetinib vs. PI3K抑制剂AZD5363),极大提高了试验效率。平台试验作为一种新型的临床试验模式,通过同一平台对多种治疗策略进行评估,显著提高了研究效率。VIKTORY伞式试验和SMC的平台试验均证实了生物标志物匹配的靶向治疗可显著延长胃癌患者的生存期。然而,平台试验的实施也面临诸多挑战,如患者入组标准、生物标志物检测标准化及数据分析复杂性等。
三、多组学技术解析免疫微环境异质性,克服免疫耐药瓶颈
多组学整合分析在胃癌预后预测和治疗响应评估中发挥着越来越重要的作用。通过整合基因组学、转录组学、蛋白质组学及空间转录组学数据,可实时理解非响应者与响应者的分子特征,为个体化治疗提供科学依据。
免疫检查点抑制剂(ICIs)在胃癌治疗中的应用日益广泛。KEYNOTE-059和ATTRACTION-2试验分别证实了帕博利珠单抗和纳武利尤单抗在PD-L1阳性或CPS≥5的胃癌患者中的有效性。然而,并非所有患者都能从ICIs治疗中获益,MSI-H/dMMR、EBV阳性及PD-L1阳性患者响应率较高,而MSS患者响应率较低。
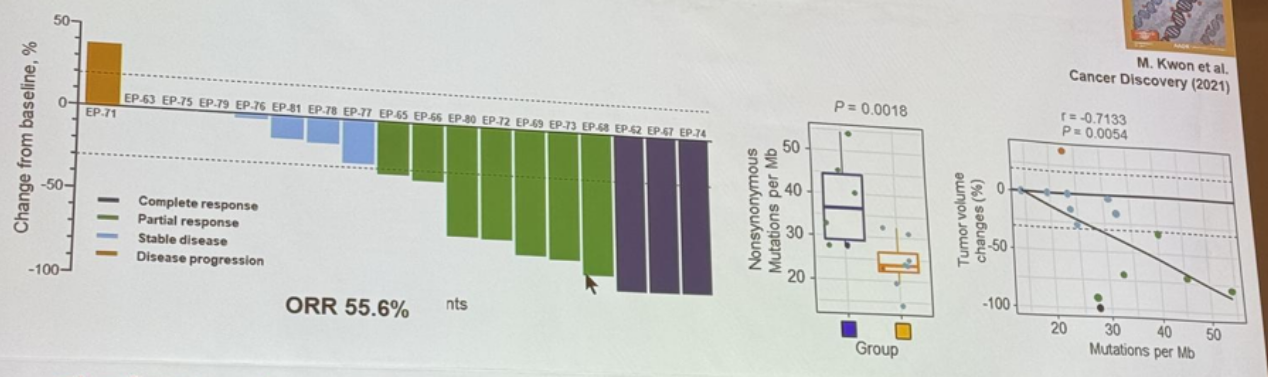 图2. TMB与免疫治疗疗效呈正相关
图2. TMB与免疫治疗疗效呈正相关
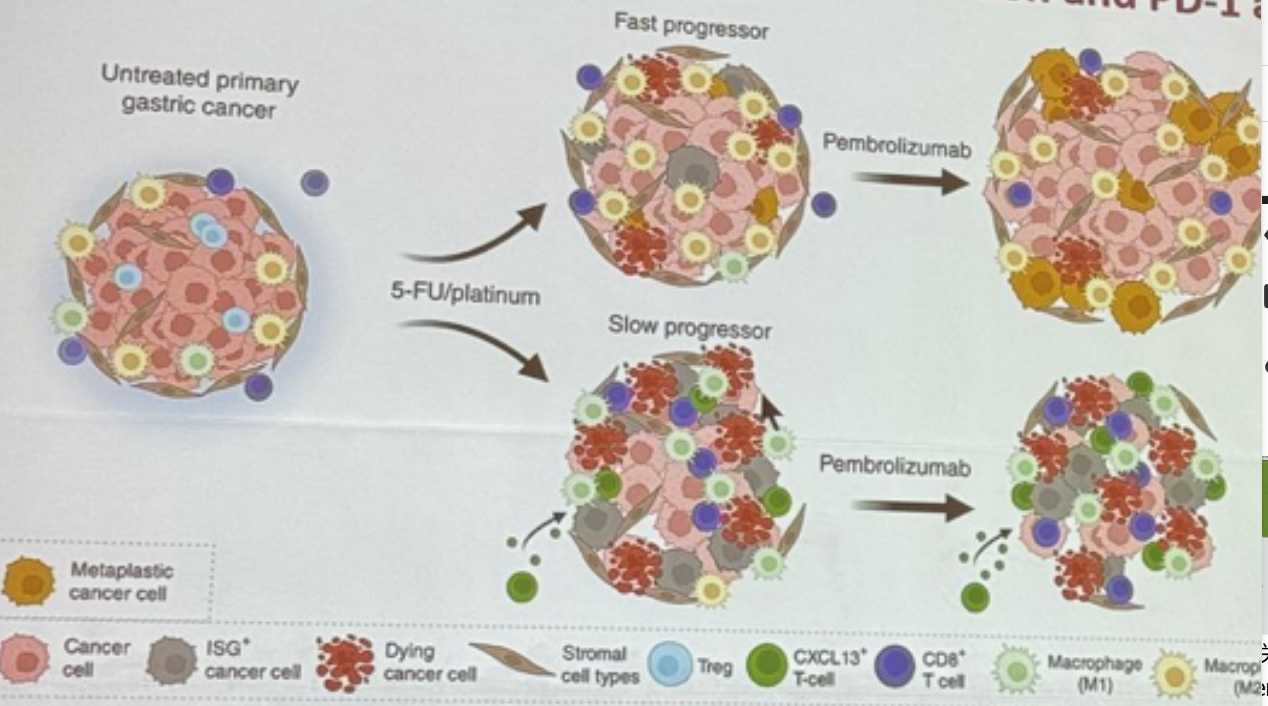 图3. 免疫治疗重塑胃癌免疫微环境
图3. 免疫治疗重塑胃癌免疫微环境
一项尚未公开发表的Ⅱ期研究评估了Ceralasertib(ATR抑制剂)联合Durvalumab在PD-L1阳性、IO耐药晚期胃癌中的疗效。初步数据显示,该组合在PD-L1阳性患者中表现出一定的抗肿瘤活性。其可能的机制包括ATR失活导致DNA损伤修复缺陷积累,进而增强基因组不稳定性并激活干扰素基因刺激因子(STING)通路,重塑肿瘤免疫原性。该研究为克服免疫耐药问题提供了新的思路。
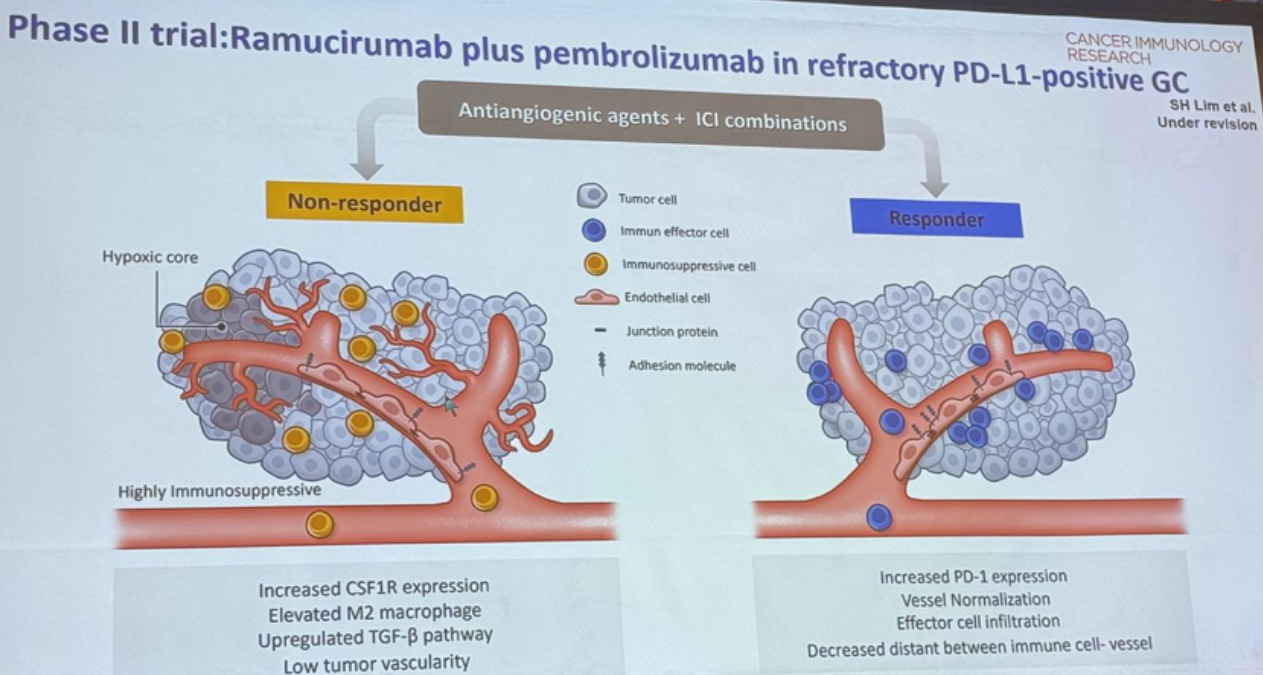 图4. 多组学技术靶向联合免疫治疗应答者主要分子特征
图4. 多组学技术靶向联合免疫治疗应答者主要分子特征
四、未来展望
胃癌治疗领域正经历着从传统化疗向精准医疗的深刻转变。靶向治疗、免疫治疗及新型疗法的不断涌现为胃癌患者提供了更多的治疗选择。然而,如何根据患者的分子特征选择最佳治疗方案仍是临床面临的主要挑战。未来,随着多组学技术的不断发展及平台试验模式的广泛应用,胃癌的精准治疗将取得更大突破。我们期待通过全球科研人员的共同努力,早日实现胃癌的个体化、精准化治疗。

- 推荐文章
