- 首页 > 正文
ESMO 2025丨FORTITUDE-101研究初步OS结果公布,可能不具备临床意义
发表时间:2026-02-06 12:56:48
编者按
胃癌或胃食管交界处癌(G/GEJC)的靶向治疗长期受限于生物标志物重叠度有限、有效靶点缺乏等问题,成纤维细胞生长因子受体2b(FGFR2b)过表达为约16%的患者提供了新的治疗方向。ESMO 2025大会公布的FORTITUDE-101Ⅲ期试验结果,首次证实了FGFR2b抑制剂Bemarituzumab(贝玛妥珠单抗)联合化疗的短期生存获益,但长期分析中疗效信号减弱的现象,为该药物的临床应用及后续研究带来了重要启示。本文将完整呈现该试验核心数据及专家解读,为临床实践提供参考。
一、研究背景与试验基础
多数胃食管癌为TP53突变型、染色体不稳定肿瘤,并可能同时存在其他基因变异,所以靶向单一致癌基因往往达不到理想的治疗效果。目前临床多通过肿瘤免疫组化检测错配修复(MMR)、HER2、PD-L1和CLD18.2以指导一线治疗,但生物标志物重叠度有限。而FGFR2b作为新兴靶点,为缺乏有效靶点的患者提供了新的选择——约16%的患者肿瘤细胞中FGFR2b蛋白过表达比例≥10%[1]。
此前,在Ⅱ期FIGHT试验中,选择性抑制剂贝玛妥珠单抗对于FGFR2b过表达患者已显示出疗效潜力[2],这为Ⅲ期FORTITUDE-101研究的开展奠定了基础。柏林时间10月25日,韩国Sun Young Rha教授在ESMO大会主席研讨会上报告了该Ⅲ期研究的初步生存结果(摘要号:LBA10)。
二、FORTITUDE-101试验核心数据
该试验纳入324例FGFR2b过表达(≥10%肿瘤细胞)、不可切除或转移性胃癌或胃食管交界癌患者,对比贝玛妥珠单抗联合mFOLFOX6方案与安慰剂联合mFOLFOX6方案的疗效差异,核心数据如下:
1. 预设中期分析结果:主要终点达成
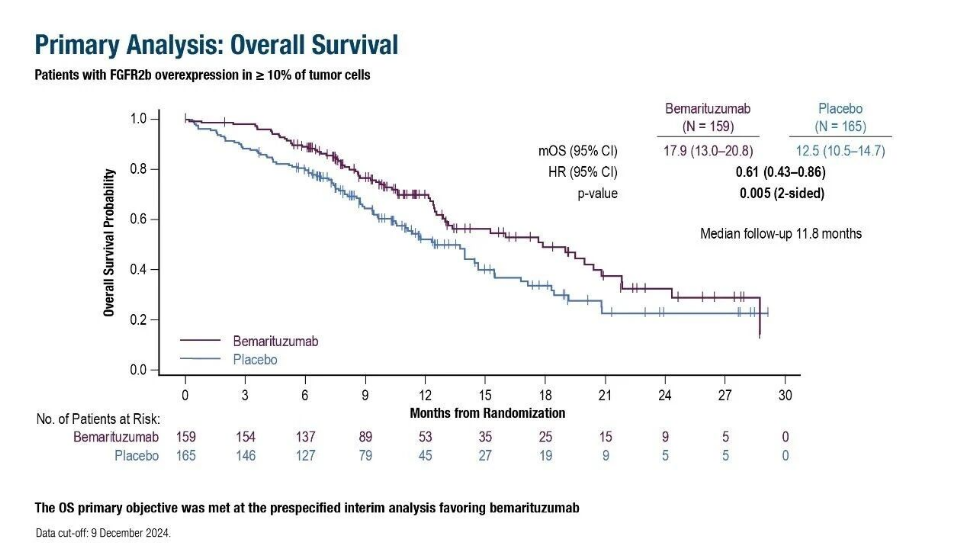
中位随访11.8个月时,贝玛妥珠单抗组中位总生存期(OS)为17.9个月,安慰剂组为12.5个月(风险比[HR] 0.61;95%CI:0.43~0.86;P=0.005,图1);中位随访11.1个月时,中位无进展生存期(PFS)为8.6个月 vs. 6.7个月(HR 0.71;95%CI:0.53~0.95;P=0.019);客观缓解率(ORR)为45.9% vs. 44.8%(P=0.90)。
2. 后续长期分析结果:疗效信号减弱
在中位随访19.4个月的后续分析中,两组中位OS差异缩小(14.5个月 vs. 13.2个月;HR 0.82;95%CI:0.62~1.08),这表明可能不具备临床意义。
安全性方面,贝玛妥珠单抗组≥3级治疗相关不良事件发生率为60%,最常见为可逆性角膜事件,安慰剂组为18%。
三、专家解读与未来展望
美国纽约纪念斯隆·凯特琳癌症中心的Yelena Janjigian博士对试验结果进行了深度解读:“初始OS数据显示5个月的差异具有临床意义,根据修订后的统计学标准被确定为主要分析结果,尽管中位随访不足1年且约40%患者为研究最后6个月入组。7个月后,随着随访时间延长,OS和PFS曲线趋近,提示疗效信号减弱。这种减弱可能反映数据成熟度和生物标志物异质性,而非治疗组间失衡——两组后续治疗暴露相似。”
临床前研究表明,贝玛妥珠单抗可调节肿瘤微环境,增强对PD-1抗体的敏感性[3]。目前正在进行的Ⅰb/Ⅲ期FORTITUDE-102试验,正探索mFOLFOX6联合纳武利尤单抗及贝玛妥珠单抗或安慰剂在FGFR2b过表达(≥10%肿瘤细胞)患者中的疗效[4]。
Janjigian博士补充:“FORTITUDE-101试验中仅37%患者PD-L1联合阳性评分≥5%,若该比例代表FGFR2b高表达人群,则纳武利尤单抗联合贝玛妥珠单抗在FORTITUDE-102中可能足以改善预后。尽管FORTITUDE-101的初步OS数据令人鼓舞,仍需更多数据确定贝玛妥珠单抗能否成为一线标准治疗——其可能在后线治疗中具有价值。”她指出,未来研究方向可能主要集中在:克服异质性和局灶性表达的FGFR2b抗体药物偶联物、促进受体降解的双特异性抗体、双特异性抗体(如FGFR2b×CD3或PD-1)及早期PROTAC降解剂消除FGFR2信号通路。
参考文献
[1]JCO Precis Oncol. 2025;9:e2400710
[2]Gastric Cancer. 2024;27:558–570
[3]MAbs. 2021;13:1981202
[4]J Clin Oncol. 2022;40(Suppl 16):TPS4165
胃癌或胃食管交界处癌(G/GEJC)的靶向治疗长期受限于生物标志物重叠度有限、有效靶点缺乏等问题,成纤维细胞生长因子受体2b(FGFR2b)过表达为约16%的患者提供了新的治疗方向。ESMO 2025大会公布的FORTITUDE-101Ⅲ期试验结果,首次证实了FGFR2b抑制剂Bemarituzumab(贝玛妥珠单抗)联合化疗的短期生存获益,但长期分析中疗效信号减弱的现象,为该药物的临床应用及后续研究带来了重要启示。本文将完整呈现该试验核心数据及专家解读,为临床实践提供参考。
一、研究背景与试验基础
多数胃食管癌为TP53突变型、染色体不稳定肿瘤,并可能同时存在其他基因变异,所以靶向单一致癌基因往往达不到理想的治疗效果。目前临床多通过肿瘤免疫组化检测错配修复(MMR)、HER2、PD-L1和CLD18.2以指导一线治疗,但生物标志物重叠度有限。而FGFR2b作为新兴靶点,为缺乏有效靶点的患者提供了新的选择——约16%的患者肿瘤细胞中FGFR2b蛋白过表达比例≥10%[1]。
此前,在Ⅱ期FIGHT试验中,选择性抑制剂贝玛妥珠单抗对于FGFR2b过表达患者已显示出疗效潜力[2],这为Ⅲ期FORTITUDE-101研究的开展奠定了基础。柏林时间10月25日,韩国Sun Young Rha教授在ESMO大会主席研讨会上报告了该Ⅲ期研究的初步生存结果(摘要号:LBA10)。

二、FORTITUDE-101试验核心数据
该试验纳入324例FGFR2b过表达(≥10%肿瘤细胞)、不可切除或转移性胃癌或胃食管交界癌患者,对比贝玛妥珠单抗联合mFOLFOX6方案与安慰剂联合mFOLFOX6方案的疗效差异,核心数据如下:
1. 预设中期分析结果:主要终点达成
中位随访11.8个月时,贝玛妥珠单抗组中位总生存期(OS)为17.9个月,安慰剂组为12.5个月(风险比[HR] 0.61;95%CI:0.43~0.86;P=0.005,图1);中位随访11.1个月时,中位无进展生存期(PFS)为8.6个月 vs. 6.7个月(HR 0.71;95%CI:0.53~0.95;P=0.019);客观缓解率(ORR)为45.9% vs. 44.8%(P=0.90)。
2. 后续长期分析结果:疗效信号减弱
在中位随访19.4个月的后续分析中,两组中位OS差异缩小(14.5个月 vs. 13.2个月;HR 0.82;95%CI:0.62~1.08),这表明可能不具备临床意义。
安全性方面,贝玛妥珠单抗组≥3级治疗相关不良事件发生率为60%,最常见为可逆性角膜事件,安慰剂组为18%。
三、专家解读与未来展望
美国纽约纪念斯隆·凯特琳癌症中心的Yelena Janjigian博士对试验结果进行了深度解读:“初始OS数据显示5个月的差异具有临床意义,根据修订后的统计学标准被确定为主要分析结果,尽管中位随访不足1年且约40%患者为研究最后6个月入组。7个月后,随着随访时间延长,OS和PFS曲线趋近,提示疗效信号减弱。这种减弱可能反映数据成熟度和生物标志物异质性,而非治疗组间失衡——两组后续治疗暴露相似。”
临床前研究表明,贝玛妥珠单抗可调节肿瘤微环境,增强对PD-1抗体的敏感性[3]。目前正在进行的Ⅰb/Ⅲ期FORTITUDE-102试验,正探索mFOLFOX6联合纳武利尤单抗及贝玛妥珠单抗或安慰剂在FGFR2b过表达(≥10%肿瘤细胞)患者中的疗效[4]。
Janjigian博士补充:“FORTITUDE-101试验中仅37%患者PD-L1联合阳性评分≥5%,若该比例代表FGFR2b高表达人群,则纳武利尤单抗联合贝玛妥珠单抗在FORTITUDE-102中可能足以改善预后。尽管FORTITUDE-101的初步OS数据令人鼓舞,仍需更多数据确定贝玛妥珠单抗能否成为一线标准治疗——其可能在后线治疗中具有价值。”她指出,未来研究方向可能主要集中在:克服异质性和局灶性表达的FGFR2b抗体药物偶联物、促进受体降解的双特异性抗体、双特异性抗体(如FGFR2b×CD3或PD-1)及早期PROTAC降解剂消除FGFR2信号通路。
参考文献
[1]JCO Precis Oncol. 2025;9:e2400710
[2]Gastric Cancer. 2024;27:558–570
[3]MAbs. 2021;13:1981202
[4]J Clin Oncol. 2022;40(Suppl 16):TPS4165
- 推荐文章
ESMO CHINA FOCUS中国视角论坛丨消化肿瘤专场:替雷利珠单抗引领治疗革新,精准策略点亮临床未来
ESMO 2025前沿丨晚期神经内分泌肿瘤新型放射治疗疗效值得期待
ESMO 2025丨FORTITUDE-101研究初步OS结果公布,可能不具备临床意义
岂有此“例”丨全球首例胃型十二指肠癌+胃癌碰撞瘤,术前诊断难点全解析
ESMO 2025丨重磅!三大新策略破解免疫治疗耐药困局,多线治疗失败患者迎曙光!
ESMO 2025丨KRAS G12D/V靶向治疗全面破局,四大研究改写实体瘤治疗格局
ESMO 2025国际视野丨ESMO特别贡献奖获得者Thierry Conroy教授追溯消化道肿瘤治疗变革
ESMO 2025前沿丨“冰火两重天”——HER2靶向治疗GC/GEJC令人惊喜,免疫联合折戟成沙
ESMO 2025 AI热潮来袭:大会主席专访定调转型方向,结直肠癌研究彰显临床价值
2025 ESMO速递丨胰腺癌新药研究取得突破,生物标志物指导PDAC个性化治疗
ESMO 2025丨重磅!KRAS G12C抑制剂多点突破,耐药与难治性实体瘤患者迎来新曙光
2025 ESMO速递:“靶免联合”拓展胃癌精准治疗新视野
高危胃肠道间质瘤(GIST)术后辅助治疗的五大争议与决策
胃食管交界部癌的多模式治疗:现状与未来方向丨2025韩国国际胃癌周
Jeeyun Lee教授解析多组学技术如何重塑胃癌免疫微环境丨2025韩国国际胃癌周
王绿化教授解析食管癌临床研究新进展:免疫治疗引领格局变革,中国原创方案重塑国际标准丨CSCO 2025
Nature Medicine丨AI赋能结直肠癌手术:个性化围手术期治疗的临床突破与未来方向
Joo Ha Hwang教授详解胃癌一、二级预防全球行动丨2025韩国国际胃癌周
食管鳞癌新辅助治疗迎来新突破!化免方案VS放化疗,生存、复发数据全面对比
李健教授:探索胃肠间质瘤联合治疗新策略,攻克TKIs耐药难关丨CACA东北整合肿瘤学大会 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025-09-30 19:15:32 河北 手机阅读
共探胃癌诊疗新路径!2025韩国国际胃癌周中韩专场顺利举办,四大前沿研究擘画治疗未来
CACA东北整合肿瘤学大会丨徐泽宽教授:精准治疗时代胃癌诊疗机遇和挑战并存
应杰儿教授:以“整合”破局胃癌诊疗难题,以“康复”守护患者长期预后丨2025CACA东北整合肿瘤学大会
王峰教授展望未来食管癌精准免疫治疗新策略丨CSCO名家演讲集
ESMO 2025丨LBA重磅发布,消化道肿瘤领域最新进展一文纵览!
王峰教授:食管癌免疫治疗2.0时代:新联合策略+耐药探索丨CSCO名家演讲集
CACA东北整合肿瘤学大会丨李茂全教授:建立“诊、治、康、护、养”完整诊疗体系,推动胰腺癌个体化和规范化诊疗 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025年9月25日 18:20
聚焦胃癌肝转移诊疗新进展:陈凛教授解析外科价值与多学科协作策略丨2025CACA东北整合肿瘤学大会
国际视角丨年轻人注意!早发性癌症发病率上升,肥胖和代谢差可能是“关键推手”
CSCO 2025丨吴胤瑛教授深度解读神经内分泌瘤诊疗指南更新,破局副神经节瘤精准诊疗新纪元
CSCO 2025丨方维佳教授详解肝癌围手术期免疫治疗新进展,这些突破值得关注!
CSCO 2025丨钱浩然主任医师解读高危GIST术后辅助治疗指南推荐与五大争议热点的破局之道
CSCO 2025丨王理伟教授解析晚期胰腺癌新药研究进展,精准治疗开启多靶点探索新时代
CSCO 2025丨邓艳红教授:结直肠癌中FOLFOXIRI三药方案临床应用进展
“瘤瘤”新知丨真实世界研究表明风险分层工具可提高上消化道肿瘤检出率
CSCO 2025丨项晓军教授:免疫治疗重塑胃癌“慢病化”全程管理新范式
岂有此“例”丨一例CLDN18.2阳性晚期胃癌患者接受含佐妥昔单抗治疗后出现胃炎的病例分析
CSCO名家视点丨李恩孝教授:胆道恶性肿瘤中国专家共识发布,加速我国胆道肿瘤诊疗规范化和精准化进程
CSCO 2025丨从“千人一方”到“量体裁衣",唐勇教授揭秘胃癌免疫治疗的精准标尺与分层策略
CSCO 2025丨勾红峰教授:免疫治疗时代下局部进展期胃癌诊治策略革新,豁免手术或成为可能
国际视角丨KRAS G12C突变结直肠癌最新进展:联合疗法开启治疗新纪元
术前贫血对直肠癌保肛手术近期及远期疗效有哪些影响?一项回顾性研究揭晓答案
革故鼎新,步召德教授详解直肠癌新辅助治疗的进展、挑战与未来变革|华夏结直肠病学论坛
利用真实世界数据提升临床试验结果普适性:一项前瞻性研究带来的洞见
杨林教授解读结直肠癌免疫治疗进展:精准分层与动态监测是未来方向|华夏结直肠病学论坛
沈琳教授团队:非V600E BRAF突变转移性结直肠癌的持续挑战与前沿治疗策略
华夏结直肠病学论坛丨孙立峰教授:聚焦结直肠癌腹膜转移个体化和精准化治疗策略
素食防癌再添实锤!最新研究表明吃素可降低癌症风险
“瘤瘤”新知丨AI导致内镜医师技能退化?《柳叶刀》研究揭示医疗AI的双刃剑效应
“冷肿瘤”破局之道:胡志前教授解读MSS型结直肠癌免疫治疗困境及探索|华夏结直肠病学论坛
岂有此“例”丨从脂肪肝到肝癌——一例MASH相关肝细胞癌的长期管理与成功移植
老年Ⅱ~Ⅲ期结直肠癌患者能否从奥沙利铂辅助化疗中获益?大型回顾性研究为您答疑解惑
血液or组织?转移性结直肠癌生物标志物检测最佳标本如何选择
谋“防”重“治”,毛友生教授详解中国食管癌防治优化之路与青年医师培养新策|2025CACA华中整合肿瘤学大会
心灵驿站丨生与死的奇妙共舞
