- 首页 > 正文
岂有此“例”丨反常规病例!一例MSI-H转移性结肠癌患者免疫治疗失败的病例报告
发表时间:2026-02-06 22:16:17
编者按
免疫检查点抑制剂(ICIs)的应用,已彻底改变错配修复缺陷(dMMR)/微卫星高度不稳定(MSI-H)结直肠癌(CRC)的治疗格局,NCCN、ESMO等指南均将其推荐为该类转移性患者的一线方案。但临床实践中,仍有约50%的dMMR/MSI-H CRC患者对ICIs存在原发性耐药,成为制约治疗获益的关键瓶颈。
本期《岂有此“例”》聚焦一例84岁右半结肠低分化腺癌患者,虽具备MSI-H、肿瘤突变负荷高(TMB-H)、HLA杂合性等ICIs敏感的分子特征,且PD-L1表达水平较高(CPS=20),但接受PD-1抑制剂治疗4周期后仍出现疾病快速进展,总生存期仅9个月。究竟为何会出现这种情况,下面就请跟随小编一起来一探究竟吧!同时也希望本病例的分享,能够为临床医生提供真实世界的耐药参考,推动dMMR/MSI-H CRC免疫治疗向更精准、更个体化的方向发展。
病例再现
1.患者主诉
84岁,中国老年男性患者,2022年3月首次于本院就诊,此时距其行右半结肠切除术后3个月、末次化疗结束3周。
2.现病史
患者因1个月便血、腹痛就诊中国云南省某医院。近4天出现肛门梗阻、无法排气。经全面检查确诊为右半结肠癌。2021年11月29日行右半结肠切除术,术后恢复顺利。术后6周接受贝伐珠单抗联合卡培他滨治疗3周期。
3.基线人口学及临床特征
患者体重指数(BMI)21.37 kg/m2,有30年高血压病史,最高血压150/90 mmHg,每日口服依普罗沙坦600 mg控制良好。16年前曾行胆囊切除术,无糖尿病、心血管疾病或慢性肾病史。确诊前ECOG体能状态评分为0分(完全活动),就诊时降至1分。
4.社会史
否认肿瘤家族史,无吸烟、饮酒史。
5.体格检查
ECOG体能状态评分:1分。生命体征:体温36.5℃,血压138/89 mmHg,心率75次/分,呼吸频率19次/分。腹部可见15 cm纵行手术瘢痕,右下肋缘下方可见约10 cm陈旧性瘢痕。腹部柔软,无压痛。
6.实验室检查
术后病理显示8 cm低分化腺癌(图1A),肿瘤浸润超过固有肌层至纤维脂肪组织。淋巴结转移3/14枚,伴2个癌结节。免疫组化(IHC)结果:Ki67 80%(图1B),CD8+T淋巴细胞<50个/mm2(图1C)。肿瘤细胞及免疫细胞PD-L1弥漫表达,联合阳性评分(CPS)=20(图1D)。MLH1(-)、PMS2(-)、MSH2(+)、MSH6(+)(图1E-H)。
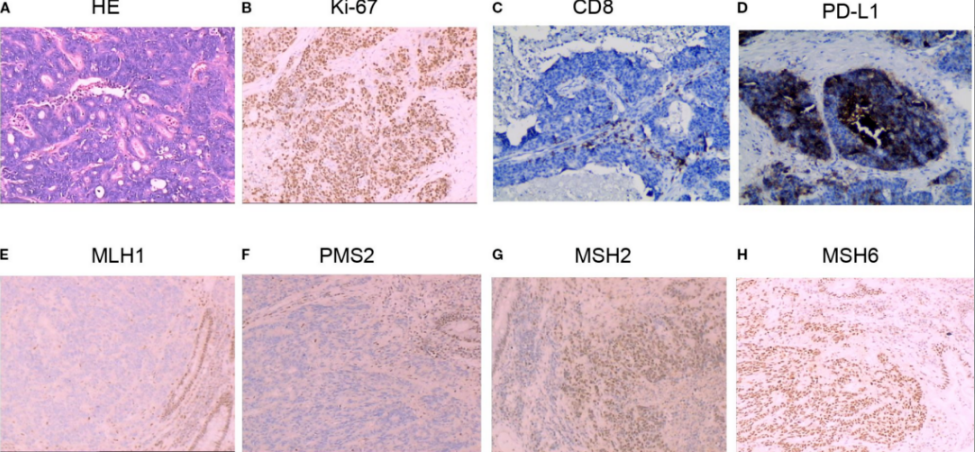 图1. 结肠癌组织学及免疫组化染色。(A)结肠术后病理显示低分化腺癌。(B)免疫组化显示Ki-67阳性率80%。(C)CD8+T淋巴细胞浸润稀疏(<50个/mm2)。(D)PD-L1表达CPS=20。(E-H)错配修复(MMR)蛋白免疫组化结果:MLH1(-)、PMS2(-)、MSH2(+)、MSH6(+)。
图1. 结肠癌组织学及免疫组化染色。(A)结肠术后病理显示低分化腺癌。(B)免疫组化显示Ki-67阳性率80%。(C)CD8+T淋巴细胞浸润稀疏(<50个/mm2)。(D)PD-L1表达CPS=20。(E-H)错配修复(MMR)蛋白免疫组化结果:MLH1(-)、PMS2(-)、MSH2(+)、MSH6(+)。
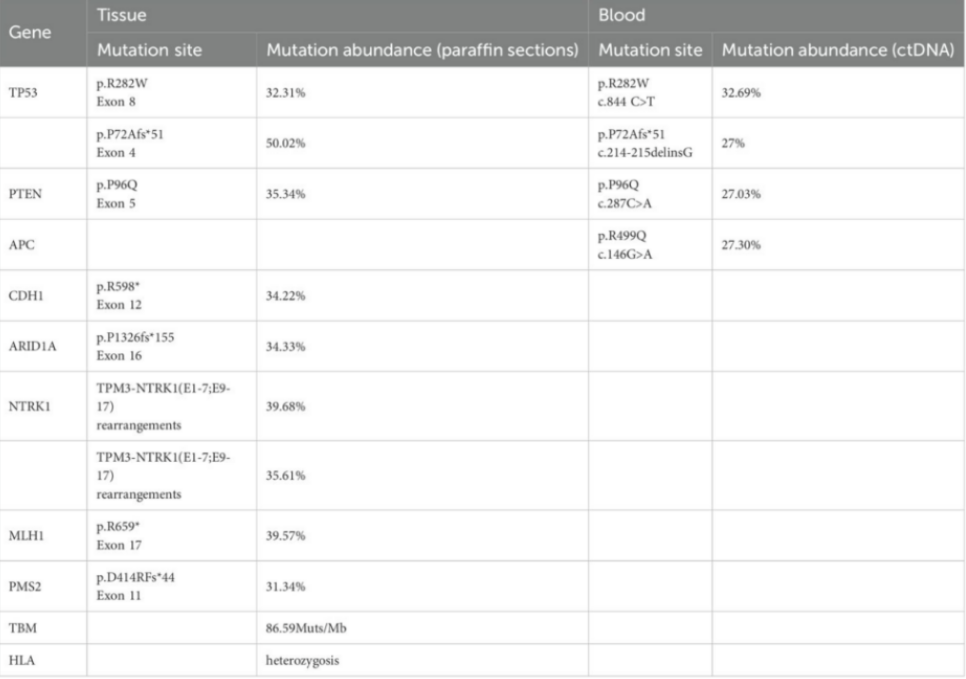
对患者术后组织蜡块及外周血ctDNA进行下一代测序(NGS)分析,结果显示MSI-H、TMB-H(86.59 Muts/Mb)、HLA杂合性、KRAS/NRAS/BRAF野生型、NTRK1重排及PTEN、TP53、CDH1等基因突变(表1)。
表1. 蜡块及血细胞测序分析结果
2021年11月24日,癌胚抗原(CEA)水平升高至126.1 μg/L(图2A),中性粒细胞-淋巴细胞比值(NLR)为3.2(图2B)。
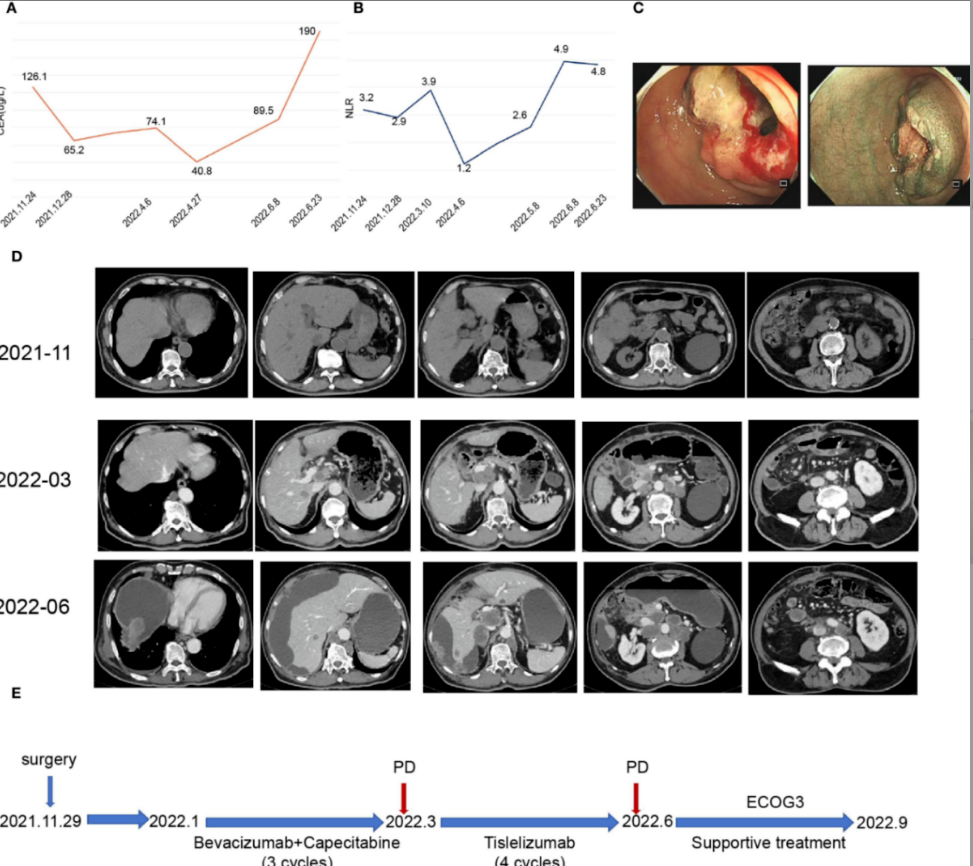 图2. 患者临床数据及治疗史。(A)治疗期间癌胚抗原(CEA)水平变化曲线。(B)治疗期间中性粒细胞-淋巴细胞比值(NLR)变化曲线。(C)肠镜显示距肛门60 cm处菜花样病灶环周生长致管腔狭窄。(D)代表性影像学图像展示治疗过程。(E)患者治疗时间轴。
图2. 患者临床数据及治疗史。(A)治疗期间癌胚抗原(CEA)水平变化曲线。(B)治疗期间中性粒细胞-淋巴细胞比值(NLR)变化曲线。(C)肠镜显示距肛门60 cm处菜花样病灶环周生长致管腔狭窄。(D)代表性影像学图像展示治疗过程。(E)患者治疗时间轴。
7.影像学检查
肠镜显示距肛门60 cm处见菜花样肿物,环周生长致管腔狭窄,无法通过CF-H290I内镜(图2C)。
CT检查显示结肠肝曲恶性肿瘤伴狭窄,腹腔及腹膜后多发淋巴结转移(图2D)。
8.最终诊断
结合患者病史,最终诊断为右半结肠低分化腺癌,病理分期pT3N2M1c(临床IVc期)。
9.治疗
2022年3月,患者出现3级手足综合征及2级骨髓抑制。免疫组化及基因检测显示dMMR/MSI-H状态,遂调整治疗方案为替雷利珠单抗免疫治疗(200 mg,每3周1次)。诊疗决策详细时间轴如下:
2021年11月
因完全性肠梗阻4天收入当地医院。
急诊肠镜显示右半结肠梗阻性肿块。
CT确诊结肠肝曲肿瘤伴腹膜转移。
决策依据:完全性肠梗阻需手术治疗。
2021年11月29日行右半结肠切除术。
2022年1月
决策依据:IV期诊断且功能状态保留(ECOG 1分),启动一线贝伐珠单抗联合卡培他滨化疗,每3周1次,共3周期。
2022年3月
因3级手足综合征及2级骨髓抑制就诊我院。
决策依据:基于dMMR/MSI-H状态及治疗相关毒性,改用免疫治疗。
启动替雷利珠单抗200 mg每3周1次治疗。
10.转归与随访
治疗期间患者CEA水平随疾病进展波动(图2A),NLR持续高于3(图2B)。尽管接受4周期免疫治疗,2022年6月随访CT显示疾病进展(图2D)。患者体能状态显著恶化,ECOG评分降至3分,需最佳支持治疗:胸腔穿刺治疗恶性胸腔积液;肠内及肠外营养维持热量摄入;按WHO镇痛阶梯实施全面疼痛控制。尽管接受最佳支持治疗,患者仍于2022年9月因病去世,自初诊起总生存期为9个月(图2E)。
病例分析
本病例报道了一例具有MSI-H/TMB-H特征及HLA杂合性的结肠癌患者,其基因组特征通常预示对免疫检查点抑制剂敏感,但患者在PD-1抑制剂治疗后出现快速疾病进展及体能状态急剧恶化。这一意外反应促使我们深入探究潜在的耐药机制。
基线高危因素分析
该84岁患者存在多个不良预后因素:低分化组织学(Ki-67指数80%)提示肿瘤侵袭性强。值得注意的是,尽管TMB-H通常预示化疗敏感,但患者在一线贝伐珠单抗联合卡培他滨治疗期间即出现原发耐药,表现为CEA水平持续升高。PTEN突变可能通过AKT通路激活损害DNA损伤应答,从而降低化疗疗效。
二线免疫治疗失败的潜在机制包括:(1)年龄相关T细胞功能障碍.衰老相关的CD8+组织驻留记忆T细胞功能受损可能削弱抗肿瘤免疫应答。(2)系统性炎症。治疗期间持续升高的中性粒细胞-淋巴细胞比值(NLR≥3)与免疫治疗不良预后相关,可能通过CD80/CD86-CTLA4轴介导免疫抑制。
基因突变与肿瘤微环境特征
基因检测发现PTEN、CDH1、APC突变,但缺乏蛋白表达验证是本研究局限。尽管PD-L1高表达,肿瘤微环境显示CD8+T细胞浸润极低。现有文献表明这些突变可能通过复杂信号网络破坏免疫细胞亚群(如Tregs、MDSCs、TAMs),形成免疫抑制微环境,阻碍CD8+T细胞活性。例如,PTEN突变与dMMR/MSI-H胃肠道肿瘤对PD-1抑制剂反应降低相关,可能通过PI3K/AKT/mTOR通路激活及CD8+T细胞耗竭介导。CDH1突变可能通过CD56 bright NK细胞聚集促进免疫逃逸,而APC缺失可能通过β-catenin/TCF4-PD-L1轴激活及WNT通路失调降低免疫治疗敏感性。这些发现强调了免疫逃逸及治疗耐药的潜在机制。
NTRK融合的临床意义
NTRK融合与MSI-H共存符合NTRK重排结直肠癌的特征(通常为BRAF/RAS野生型)。尽管靶向治疗(如恩曲替尼)提供潜在挽救方案,但患者因ECOG评分快速恶化无法实施。dMMR CRC中NTRK融合发生率为1-5%,尤其在MLH1/MSH2缺陷患者中,但其与免疫治疗耐药的关系需进一步研究。
本病例提示,即使存在TMB-H/HLA杂合性,高风险dMMR/MSI-H患者(低分化、腹膜转移、NLR≥3)仍需警惕原发耐药。潜在策略包括:
ICIs联合治疗
联合不同ICIs是克服肠癌免疫耐药的策略。CheckMate 142研究5年随访数据显示,纳武利尤单抗(NIVO)联合伊匹木单抗推荐用于dMMR/MSI-H晚期肠癌全线治疗。CheckMate 8HW试验显示,NIVO联合伊匹木单抗在MSI-H/dMMR转移性结直肠癌患者中疗效优于NIVO单药,不仅显著延长无进展生存期,长期随访还显示持久应答,提示可能克服单药免疫治疗耐药。LAG-3通过抑制T细胞增殖及细胞因子产生促进肿瘤逃逸。PD-1与LAG-3双抑制被认为可增强对PD-1/PD-L1抑制剂耐药患者的免疫应答。2022年FDA批准纳武利尤单抗联合瑞拉利单抗(LAG-3抑制剂)用于不可切除或转移性黑色素瘤治疗。2023年ESMO大会报道的NICHE-3研究首次证实纳武利尤单抗联合瑞拉利单抗在dMMR结肠癌中的疗效及安全性,总体病理缓解率达100%。
新型靶向免疫治疗
鸟苷酸环化酶C(GCC)在约95%结直肠癌中表达,是CRC特异性肿瘤标志物。靶向GCC的CAR-T细胞疗法在转移性结直肠癌动物模型中显示明确疗效。近期I期临床试验报道,靶向GCC的CAR-T疗法IM96在至少三线治疗失败的GCC阳性转移性CRC患者中疾病控制率(DCR)达66.7%,应答者肿瘤缓解持续超过9个月。转化生长因子-β(TGF-β)通过抑制T细胞溶解相关基因(如穿孔素、颗粒酶A/B及干扰素-γ)抑制CD8+T细胞细胞毒性。整合素αvβ6是TGF-β的主要激活因子,其抑制可阻断TGF-β激活,防止肿瘤免疫逃逸,增强免疫检查点阻断疗效,是CRC的潜在治疗靶点。此外,TIM-3、TIGIT、B7-H3等新型免疫检查点的发现可能有助于克服实体瘤免疫耐药。
ICIs与抗血管生成药物联合治疗
抗血管生成治疗可通过促进效应T细胞浸润及减少肿瘤微环境(TME)中抑制性成分(如Tregs、MDSCs、M2-TAM)增强免疫治疗疗效并抑制肿瘤生长。REGONIVO研究显示,小分子多靶点抗血管生成药物瑞戈非尼联合纳武利尤单抗在三线及以上治疗失败的转移性肠癌患者中客观缓解率(ORR)达36%。因此,抗血管生成药物与免疫治疗的联合是克服免疫耐药的策略。
靶向治疗
针对罕见分子改变的靶向药物为免疫治疗失败的dMMR/MSI-H CRC患者提供可行方案。HER2及NTRK靶向治疗已显示前景。有证据表明,同时存在MSI-H和可操作基因突变的CRC患者可能代表dMMR/MSI-H肿瘤的独特分子亚型。多研究报道HER2扩增或过表达在原发性CRC中的发生率为2.2%-9.5%。MOUNTAINEER试验显示,图卡替尼联合曲妥珠单抗在RAS野生型/HER2阳性不可切除或转移性CRC患者中客观缓解率(ORR)达38.1%,32例应答者中有3例完全缓解。基于此,FDA于2023年1月加速批准该方案用于至少一线化疗后进展的RAS野生型/HER2阳性不可切除或转移性CRC。此外,抗体偶联药物(ADC)如德曲妥珠单抗(T-DXd,DS-8201)在转移性CRC后线治疗中显示前景,客观缓解率(ORR)达45.3%。临床研究一致表明,TRK抑制剂在晚期NTRK重排肿瘤(无论原发部位或组织学类型)中疗效显著。FDA已批准恩曲替尼及拉罗替尼用于局部晚期或转移性NTRK融合阳性实体瘤治疗。
总之,本病例报道一例转移性右半结肠癌患者(dMMR/MSI-H/TMB-H/HLA杂合性)对PD-1免疫治疗原发性耐药,尽管肿瘤PD-L1高表达,但CD8+T细胞浸润极低,提示免疫学“冷”肿瘤微环境。尽管免疫治疗改变了dMMR/MSI-H CRC的治疗格局,但本研究提示PTEN/CDH1/APC突变、高龄相关免疫衰老及持续升高的中性粒细胞-淋巴细胞比值(NLR>3)可能共同驱动原发耐药,强调需整合肿瘤突变谱、微环境分析及宿主因素优化高风险亚组治疗。
参考文献:Li R, Lin YP, Shen X, Guo JY, Zhang Y, Tang JD, Xie L, Hu FD. Case Report: Failed response to anti-PD-1 immunotherapy in a colon cancer patient with high microsatellite instability. Front Oncol. 2025 Oct 7;15:1636122.
免疫检查点抑制剂(ICIs)的应用,已彻底改变错配修复缺陷(dMMR)/微卫星高度不稳定(MSI-H)结直肠癌(CRC)的治疗格局,NCCN、ESMO等指南均将其推荐为该类转移性患者的一线方案。但临床实践中,仍有约50%的dMMR/MSI-H CRC患者对ICIs存在原发性耐药,成为制约治疗获益的关键瓶颈。
本期《岂有此“例”》聚焦一例84岁右半结肠低分化腺癌患者,虽具备MSI-H、肿瘤突变负荷高(TMB-H)、HLA杂合性等ICIs敏感的分子特征,且PD-L1表达水平较高(CPS=20),但接受PD-1抑制剂治疗4周期后仍出现疾病快速进展,总生存期仅9个月。究竟为何会出现这种情况,下面就请跟随小编一起来一探究竟吧!同时也希望本病例的分享,能够为临床医生提供真实世界的耐药参考,推动dMMR/MSI-H CRC免疫治疗向更精准、更个体化的方向发展。
病例再现
1.患者主诉
84岁,中国老年男性患者,2022年3月首次于本院就诊,此时距其行右半结肠切除术后3个月、末次化疗结束3周。
2.现病史
患者因1个月便血、腹痛就诊中国云南省某医院。近4天出现肛门梗阻、无法排气。经全面检查确诊为右半结肠癌。2021年11月29日行右半结肠切除术,术后恢复顺利。术后6周接受贝伐珠单抗联合卡培他滨治疗3周期。
3.基线人口学及临床特征
患者体重指数(BMI)21.37 kg/m2,有30年高血压病史,最高血压150/90 mmHg,每日口服依普罗沙坦600 mg控制良好。16年前曾行胆囊切除术,无糖尿病、心血管疾病或慢性肾病史。确诊前ECOG体能状态评分为0分(完全活动),就诊时降至1分。
4.社会史
否认肿瘤家族史,无吸烟、饮酒史。
5.体格检查
ECOG体能状态评分:1分。生命体征:体温36.5℃,血压138/89 mmHg,心率75次/分,呼吸频率19次/分。腹部可见15 cm纵行手术瘢痕,右下肋缘下方可见约10 cm陈旧性瘢痕。腹部柔软,无压痛。
6.实验室检查
术后病理显示8 cm低分化腺癌(图1A),肿瘤浸润超过固有肌层至纤维脂肪组织。淋巴结转移3/14枚,伴2个癌结节。免疫组化(IHC)结果:Ki67 80%(图1B),CD8+T淋巴细胞<50个/mm2(图1C)。肿瘤细胞及免疫细胞PD-L1弥漫表达,联合阳性评分(CPS)=20(图1D)。MLH1(-)、PMS2(-)、MSH2(+)、MSH6(+)(图1E-H)。
 图1. 结肠癌组织学及免疫组化染色。(A)结肠术后病理显示低分化腺癌。(B)免疫组化显示Ki-67阳性率80%。(C)CD8+T淋巴细胞浸润稀疏(<50个/mm2)。(D)PD-L1表达CPS=20。(E-H)错配修复(MMR)蛋白免疫组化结果:MLH1(-)、PMS2(-)、MSH2(+)、MSH6(+)。
图1. 结肠癌组织学及免疫组化染色。(A)结肠术后病理显示低分化腺癌。(B)免疫组化显示Ki-67阳性率80%。(C)CD8+T淋巴细胞浸润稀疏(<50个/mm2)。(D)PD-L1表达CPS=20。(E-H)错配修复(MMR)蛋白免疫组化结果:MLH1(-)、PMS2(-)、MSH2(+)、MSH6(+)。对患者术后组织蜡块及外周血ctDNA进行下一代测序(NGS)分析,结果显示MSI-H、TMB-H(86.59 Muts/Mb)、HLA杂合性、KRAS/NRAS/BRAF野生型、NTRK1重排及PTEN、TP53、CDH1等基因突变(表1)。
表1. 蜡块及血细胞测序分析结果

2021年11月24日,癌胚抗原(CEA)水平升高至126.1 μg/L(图2A),中性粒细胞-淋巴细胞比值(NLR)为3.2(图2B)。
 图2. 患者临床数据及治疗史。(A)治疗期间癌胚抗原(CEA)水平变化曲线。(B)治疗期间中性粒细胞-淋巴细胞比值(NLR)变化曲线。(C)肠镜显示距肛门60 cm处菜花样病灶环周生长致管腔狭窄。(D)代表性影像学图像展示治疗过程。(E)患者治疗时间轴。
图2. 患者临床数据及治疗史。(A)治疗期间癌胚抗原(CEA)水平变化曲线。(B)治疗期间中性粒细胞-淋巴细胞比值(NLR)变化曲线。(C)肠镜显示距肛门60 cm处菜花样病灶环周生长致管腔狭窄。(D)代表性影像学图像展示治疗过程。(E)患者治疗时间轴。7.影像学检查
肠镜显示距肛门60 cm处见菜花样肿物,环周生长致管腔狭窄,无法通过CF-H290I内镜(图2C)。
CT检查显示结肠肝曲恶性肿瘤伴狭窄,腹腔及腹膜后多发淋巴结转移(图2D)。
8.最终诊断
结合患者病史,最终诊断为右半结肠低分化腺癌,病理分期pT3N2M1c(临床IVc期)。
9.治疗
2022年3月,患者出现3级手足综合征及2级骨髓抑制。免疫组化及基因检测显示dMMR/MSI-H状态,遂调整治疗方案为替雷利珠单抗免疫治疗(200 mg,每3周1次)。诊疗决策详细时间轴如下:
2021年11月
因完全性肠梗阻4天收入当地医院。
急诊肠镜显示右半结肠梗阻性肿块。
CT确诊结肠肝曲肿瘤伴腹膜转移。
决策依据:完全性肠梗阻需手术治疗。
2021年11月29日行右半结肠切除术。
2022年1月
决策依据:IV期诊断且功能状态保留(ECOG 1分),启动一线贝伐珠单抗联合卡培他滨化疗,每3周1次,共3周期。
2022年3月
因3级手足综合征及2级骨髓抑制就诊我院。
决策依据:基于dMMR/MSI-H状态及治疗相关毒性,改用免疫治疗。
启动替雷利珠单抗200 mg每3周1次治疗。
10.转归与随访
治疗期间患者CEA水平随疾病进展波动(图2A),NLR持续高于3(图2B)。尽管接受4周期免疫治疗,2022年6月随访CT显示疾病进展(图2D)。患者体能状态显著恶化,ECOG评分降至3分,需最佳支持治疗:胸腔穿刺治疗恶性胸腔积液;肠内及肠外营养维持热量摄入;按WHO镇痛阶梯实施全面疼痛控制。尽管接受最佳支持治疗,患者仍于2022年9月因病去世,自初诊起总生存期为9个月(图2E)。
病例分析
本病例报道了一例具有MSI-H/TMB-H特征及HLA杂合性的结肠癌患者,其基因组特征通常预示对免疫检查点抑制剂敏感,但患者在PD-1抑制剂治疗后出现快速疾病进展及体能状态急剧恶化。这一意外反应促使我们深入探究潜在的耐药机制。
基线高危因素分析
该84岁患者存在多个不良预后因素:低分化组织学(Ki-67指数80%)提示肿瘤侵袭性强。值得注意的是,尽管TMB-H通常预示化疗敏感,但患者在一线贝伐珠单抗联合卡培他滨治疗期间即出现原发耐药,表现为CEA水平持续升高。PTEN突变可能通过AKT通路激活损害DNA损伤应答,从而降低化疗疗效。
二线免疫治疗失败的潜在机制包括:(1)年龄相关T细胞功能障碍.衰老相关的CD8+组织驻留记忆T细胞功能受损可能削弱抗肿瘤免疫应答。(2)系统性炎症。治疗期间持续升高的中性粒细胞-淋巴细胞比值(NLR≥3)与免疫治疗不良预后相关,可能通过CD80/CD86-CTLA4轴介导免疫抑制。
基因突变与肿瘤微环境特征
基因检测发现PTEN、CDH1、APC突变,但缺乏蛋白表达验证是本研究局限。尽管PD-L1高表达,肿瘤微环境显示CD8+T细胞浸润极低。现有文献表明这些突变可能通过复杂信号网络破坏免疫细胞亚群(如Tregs、MDSCs、TAMs),形成免疫抑制微环境,阻碍CD8+T细胞活性。例如,PTEN突变与dMMR/MSI-H胃肠道肿瘤对PD-1抑制剂反应降低相关,可能通过PI3K/AKT/mTOR通路激活及CD8+T细胞耗竭介导。CDH1突变可能通过CD56 bright NK细胞聚集促进免疫逃逸,而APC缺失可能通过β-catenin/TCF4-PD-L1轴激活及WNT通路失调降低免疫治疗敏感性。这些发现强调了免疫逃逸及治疗耐药的潜在机制。
NTRK融合的临床意义
NTRK融合与MSI-H共存符合NTRK重排结直肠癌的特征(通常为BRAF/RAS野生型)。尽管靶向治疗(如恩曲替尼)提供潜在挽救方案,但患者因ECOG评分快速恶化无法实施。dMMR CRC中NTRK融合发生率为1-5%,尤其在MLH1/MSH2缺陷患者中,但其与免疫治疗耐药的关系需进一步研究。
本病例提示,即使存在TMB-H/HLA杂合性,高风险dMMR/MSI-H患者(低分化、腹膜转移、NLR≥3)仍需警惕原发耐药。潜在策略包括:
ICIs联合治疗
联合不同ICIs是克服肠癌免疫耐药的策略。CheckMate 142研究5年随访数据显示,纳武利尤单抗(NIVO)联合伊匹木单抗推荐用于dMMR/MSI-H晚期肠癌全线治疗。CheckMate 8HW试验显示,NIVO联合伊匹木单抗在MSI-H/dMMR转移性结直肠癌患者中疗效优于NIVO单药,不仅显著延长无进展生存期,长期随访还显示持久应答,提示可能克服单药免疫治疗耐药。LAG-3通过抑制T细胞增殖及细胞因子产生促进肿瘤逃逸。PD-1与LAG-3双抑制被认为可增强对PD-1/PD-L1抑制剂耐药患者的免疫应答。2022年FDA批准纳武利尤单抗联合瑞拉利单抗(LAG-3抑制剂)用于不可切除或转移性黑色素瘤治疗。2023年ESMO大会报道的NICHE-3研究首次证实纳武利尤单抗联合瑞拉利单抗在dMMR结肠癌中的疗效及安全性,总体病理缓解率达100%。
新型靶向免疫治疗
鸟苷酸环化酶C(GCC)在约95%结直肠癌中表达,是CRC特异性肿瘤标志物。靶向GCC的CAR-T细胞疗法在转移性结直肠癌动物模型中显示明确疗效。近期I期临床试验报道,靶向GCC的CAR-T疗法IM96在至少三线治疗失败的GCC阳性转移性CRC患者中疾病控制率(DCR)达66.7%,应答者肿瘤缓解持续超过9个月。转化生长因子-β(TGF-β)通过抑制T细胞溶解相关基因(如穿孔素、颗粒酶A/B及干扰素-γ)抑制CD8+T细胞细胞毒性。整合素αvβ6是TGF-β的主要激活因子,其抑制可阻断TGF-β激活,防止肿瘤免疫逃逸,增强免疫检查点阻断疗效,是CRC的潜在治疗靶点。此外,TIM-3、TIGIT、B7-H3等新型免疫检查点的发现可能有助于克服实体瘤免疫耐药。
ICIs与抗血管生成药物联合治疗
抗血管生成治疗可通过促进效应T细胞浸润及减少肿瘤微环境(TME)中抑制性成分(如Tregs、MDSCs、M2-TAM)增强免疫治疗疗效并抑制肿瘤生长。REGONIVO研究显示,小分子多靶点抗血管生成药物瑞戈非尼联合纳武利尤单抗在三线及以上治疗失败的转移性肠癌患者中客观缓解率(ORR)达36%。因此,抗血管生成药物与免疫治疗的联合是克服免疫耐药的策略。
靶向治疗
针对罕见分子改变的靶向药物为免疫治疗失败的dMMR/MSI-H CRC患者提供可行方案。HER2及NTRK靶向治疗已显示前景。有证据表明,同时存在MSI-H和可操作基因突变的CRC患者可能代表dMMR/MSI-H肿瘤的独特分子亚型。多研究报道HER2扩增或过表达在原发性CRC中的发生率为2.2%-9.5%。MOUNTAINEER试验显示,图卡替尼联合曲妥珠单抗在RAS野生型/HER2阳性不可切除或转移性CRC患者中客观缓解率(ORR)达38.1%,32例应答者中有3例完全缓解。基于此,FDA于2023年1月加速批准该方案用于至少一线化疗后进展的RAS野生型/HER2阳性不可切除或转移性CRC。此外,抗体偶联药物(ADC)如德曲妥珠单抗(T-DXd,DS-8201)在转移性CRC后线治疗中显示前景,客观缓解率(ORR)达45.3%。临床研究一致表明,TRK抑制剂在晚期NTRK重排肿瘤(无论原发部位或组织学类型)中疗效显著。FDA已批准恩曲替尼及拉罗替尼用于局部晚期或转移性NTRK融合阳性实体瘤治疗。
总之,本病例报道一例转移性右半结肠癌患者(dMMR/MSI-H/TMB-H/HLA杂合性)对PD-1免疫治疗原发性耐药,尽管肿瘤PD-L1高表达,但CD8+T细胞浸润极低,提示免疫学“冷”肿瘤微环境。尽管免疫治疗改变了dMMR/MSI-H CRC的治疗格局,但本研究提示PTEN/CDH1/APC突变、高龄相关免疫衰老及持续升高的中性粒细胞-淋巴细胞比值(NLR>3)可能共同驱动原发耐药,强调需整合肿瘤突变谱、微环境分析及宿主因素优化高风险亚组治疗。
参考文献:Li R, Lin YP, Shen X, Guo JY, Zhang Y, Tang JD, Xie L, Hu FD. Case Report: Failed response to anti-PD-1 immunotherapy in a colon cancer patient with high microsatellite instability. Front Oncol. 2025 Oct 7;15:1636122.
- 推荐文章
蔡三军教授:解码大肠癌MDT核心精髓,展望3.0智能融合新图景丨第十届国家癌症中心结直肠癌学术会议
岂有此“例”丨反常规病例!一例MSI-H转移性结肠癌患者免疫治疗失败的病例报告
国际视角丨寡转移性食管胃癌治疗现状与最新研究进展
王锡山教授:顺应时代发展潮流,深入推广NOSES技术,实现患者“微创”目标
刘骞教授:以精细技术筑规范之基,以精准诊疗谋预后之优丨国家癌症中心结直肠癌学术会议
Ⅲ期临床研究证实术后保持良好运动习惯显著改善患者生存
许剑民教授:REAL研究首次证实机器人手术在中低位直肠癌中具有减少局部复发和保护器官功能的双重优势
ESMO 2025前沿丨胰腺癌研究日益聚焦ADC药物与溶瘤病毒
ESMO LBA专访|遗憾!IMbrave152研究未达主要终点,TIGIT抗体未能给晚期肝癌的一线治疗增效
ESMO 2025前沿丨三项口头报告证实新免疫联合策略将突破肝癌治疗局限
京华秋韵 术启未来丨第十届国家癌症中心结直肠癌学术会议在京隆重召开!
ESMO CHINA FOCUS中国视角论坛丨消化肿瘤专场:替雷利珠单抗引领治疗革新,精准策略点亮临床未来
ESMO 2025前沿丨晚期神经内分泌肿瘤新型放射治疗疗效值得期待
ESMO 2025丨FORTITUDE-101研究初步OS结果公布,可能不具备临床意义
岂有此“例”丨全球首例胃型十二指肠癌+胃癌碰撞瘤,术前诊断难点全解析
ESMO 2025丨重磅!三大新策略破解免疫治疗耐药困局,多线治疗失败患者迎曙光!
ESMO 2025丨KRAS G12D/V靶向治疗全面破局,四大研究改写实体瘤治疗格局
ESMO 2025国际视野丨ESMO特别贡献奖获得者Thierry Conroy教授追溯消化道肿瘤治疗变革
ESMO 2025前沿丨“冰火两重天”——HER2靶向治疗GC/GEJC令人惊喜,免疫联合折戟成沙
ESMO 2025 AI热潮来袭:大会主席专访定调转型方向,结直肠癌研究彰显临床价值
2025 ESMO速递丨胰腺癌新药研究取得突破,生物标志物指导PDAC个性化治疗
ESMO 2025丨重磅!KRAS G12C抑制剂多点突破,耐药与难治性实体瘤患者迎来新曙光
2025 ESMO速递:“靶免联合”拓展胃癌精准治疗新视野
高危胃肠道间质瘤(GIST)术后辅助治疗的五大争议与决策
胃食管交界部癌的多模式治疗:现状与未来方向丨2025韩国国际胃癌周
Jeeyun Lee教授解析多组学技术如何重塑胃癌免疫微环境丨2025韩国国际胃癌周
王绿化教授解析食管癌临床研究新进展:免疫治疗引领格局变革,中国原创方案重塑国际标准丨CSCO 2025
Nature Medicine丨AI赋能结直肠癌手术:个性化围手术期治疗的临床突破与未来方向
Joo Ha Hwang教授详解胃癌一、二级预防全球行动丨2025韩国国际胃癌周
食管鳞癌新辅助治疗迎来新突破!化免方案VS放化疗,生存、复发数据全面对比
李健教授:探索胃肠间质瘤联合治疗新策略,攻克TKIs耐药难关丨CACA东北整合肿瘤学大会 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025-09-30 19:15:32 河北 手机阅读
共探胃癌诊疗新路径!2025韩国国际胃癌周中韩专场顺利举办,四大前沿研究擘画治疗未来
CACA东北整合肿瘤学大会丨徐泽宽教授:精准治疗时代胃癌诊疗机遇和挑战并存
应杰儿教授:以“整合”破局胃癌诊疗难题,以“康复”守护患者长期预后丨2025CACA东北整合肿瘤学大会
王峰教授展望未来食管癌精准免疫治疗新策略丨CSCO名家演讲集
ESMO 2025丨LBA重磅发布,消化道肿瘤领域最新进展一文纵览!
王峰教授:食管癌免疫治疗2.0时代:新联合策略+耐药探索丨CSCO名家演讲集
CACA东北整合肿瘤学大会丨李茂全教授:建立“诊、治、康、护、养”完整诊疗体系,推动胰腺癌个体化和规范化诊疗 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025年9月25日 18:20
聚焦胃癌肝转移诊疗新进展:陈凛教授解析外科价值与多学科协作策略丨2025CACA东北整合肿瘤学大会
国际视角丨年轻人注意!早发性癌症发病率上升,肥胖和代谢差可能是“关键推手”
CSCO 2025丨吴胤瑛教授深度解读神经内分泌瘤诊疗指南更新,破局副神经节瘤精准诊疗新纪元
CSCO 2025丨方维佳教授详解肝癌围手术期免疫治疗新进展,这些突破值得关注!
CSCO 2025丨钱浩然主任医师解读高危GIST术后辅助治疗指南推荐与五大争议热点的破局之道
CSCO 2025丨王理伟教授解析晚期胰腺癌新药研究进展,精准治疗开启多靶点探索新时代
CSCO 2025丨邓艳红教授:结直肠癌中FOLFOXIRI三药方案临床应用进展
“瘤瘤”新知丨真实世界研究表明风险分层工具可提高上消化道肿瘤检出率
CSCO 2025丨项晓军教授:免疫治疗重塑胃癌“慢病化”全程管理新范式
岂有此“例”丨一例CLDN18.2阳性晚期胃癌患者接受含佐妥昔单抗治疗后出现胃炎的病例分析
CSCO名家视点丨李恩孝教授:胆道恶性肿瘤中国专家共识发布,加速我国胆道肿瘤诊疗规范化和精准化进程
CSCO 2025丨从“千人一方”到“量体裁衣",唐勇教授揭秘胃癌免疫治疗的精准标尺与分层策略
CSCO 2025丨勾红峰教授:免疫治疗时代下局部进展期胃癌诊治策略革新,豁免手术或成为可能
国际视角丨KRAS G12C突变结直肠癌最新进展:联合疗法开启治疗新纪元
术前贫血对直肠癌保肛手术近期及远期疗效有哪些影响?一项回顾性研究揭晓答案
革故鼎新,步召德教授详解直肠癌新辅助治疗的进展、挑战与未来变革|华夏结直肠病学论坛
利用真实世界数据提升临床试验结果普适性:一项前瞻性研究带来的洞见
