- 首页 > 正文
樊嘉院士团队最新突破性研究成果见刊STTT:双免联合化疗或为晚期BTC一线治疗开辟新方向,有望改写临床实践指南
发表时间:2026-01-24 23:39:10
编者按
晚期胆道癌(BTC)因起病隐匿、治疗手段有限,患者预后长期不佳,中位总生存期(OS)不足一年。尽管PD-1/PD-L1抑制剂联合化疗已成为一线标准,但客观缓解率(ORR)提升有限,亟需更高效的联合方案。既往有研究表明,PD-1/PD-L1与TIGIT双重抑制可能通过协同作用增强抗肿瘤效果。
2025年8月21日,复旦大学附属中山医院樊嘉院士、周俭教授、施国明教授团队在Signal Transduction and Targeted Therapy(STTT,IF=52.7)发表ZSAB-TOP研究结果。这项多中心、单臂、Ⅱ期临床试验(NCT050231109)首次评估了替雷利珠单抗(PD-1抑制剂)+欧司珀利单抗(TIGIT抑制剂)联合吉西他滨-顺铂(GemCis)方案治疗晚期BTC的疗效与安全性。符合条件的患者采用三药联合方案:每21天周期中,替雷利珠单抗(200 mg)和欧司珀利单抗(900 mg)于第1天给药,直至不可耐受毒性或疾病进展,同时吉西他滨(1000 mg/m2)和顺铂(25 mg/m2)于第1、8天给药,最多8个周期。主要终点为研究者评估的确认ORR。本次研究结果首次验证了PD-1/TIGIT双靶点阻断联合化疗的有效性,填补了国际空白,为无法手术的晚期BTC患者提供了新选择。尽管需Ⅲ期试验进一步验证,这一成果仍为一线治疗开辟了新方向,有望改写临床指南,彰显我国学者在肿瘤免疫联合治疗领域的创新实力。现本文对研究关键内容进行了整理,以飨读者。
研究结果
患者特征
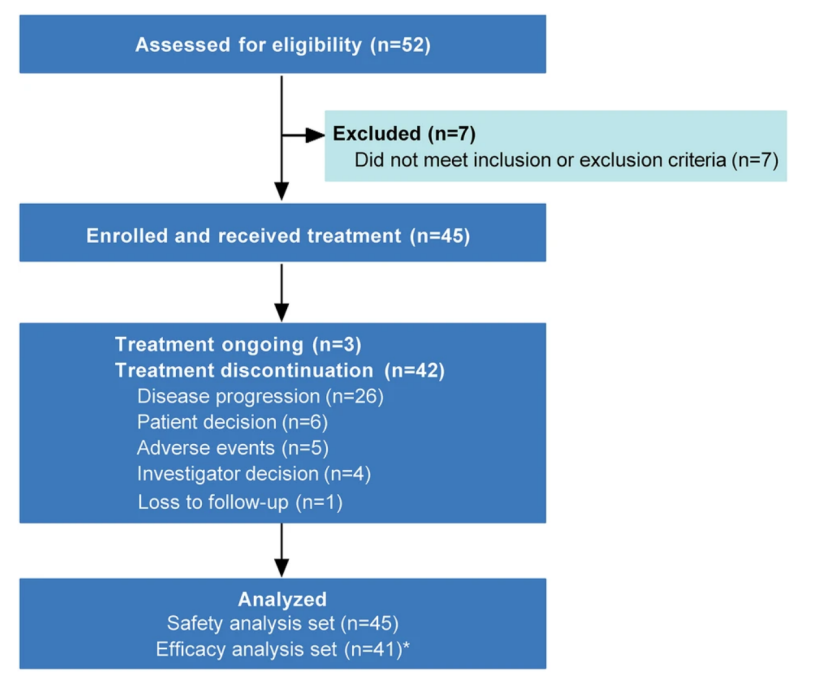
2022年3月8日~2023年1月18日期间,研究共纳入45例患者并进入安全性分析集(SAS,图1)。患者中位年龄58.0岁,男性占55.6%。多数患者为TNM分期Ⅳ期(31例,68.9%),病灶起源于肝内(34例,75.6%),且60.0%存在转移性疾病。
44例(97.8%)患者完成TIGIT和PD-L1表达水平检测,具体分布为:TIGIT+/PD-L1+(18例,40.0%)、TIGIT+/PD-L1-(2例,4.4%)、TIGIT-/PD-L1+(13例,28.9%)、TIGIT-/PD-L1-(11例,24.4%)。
疗效分析
在疗效分析集(EAS,41例)中,研究者评估的确认ORR为51.2%(21/41例;95%CI:35.1~67.1),包含3例完全缓解(CR)和18例部分缓解(PR,图2a),达到统计学优效性标准(P=0.0003)。疾病控制率(DCR)为82.9%(34/41例;95%CI:67.9~92.8),13例患者病情稳定(SD,包括2例未确认的PR)。在23例达到CR或PR(含2例未确认PR)的患者中,中位缓解持续时间(DoR)为6.4个月(95%CI:4.2~12.5)。EAS所有患者的治疗时间如图2b所示。3例(7.3%)患者经治疗后肿瘤显著缩小,符合手术指征并接受根治性手术。
亚组分析
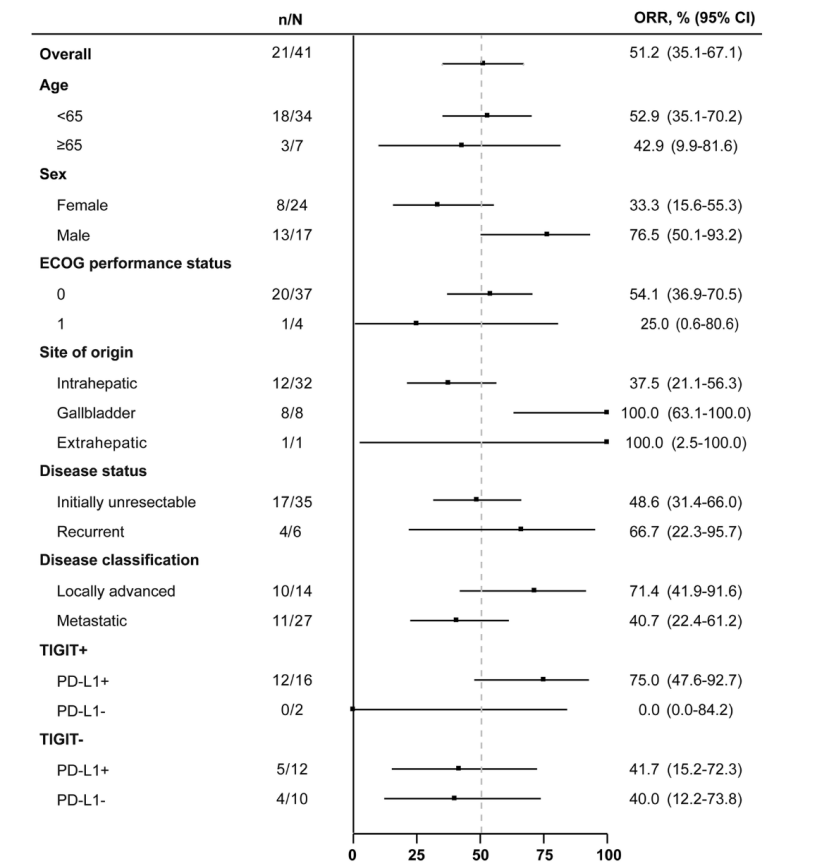
TIGIT+(12/18例,66.7%)或PD-L1+(17/28例,60.7%)患者的确认ORR高于TIGIT-(9/22例,40.9%)或PD-L1-(4/12例,33.3%)。为了进一步探索TIGIT和PD-L1状态的综合影响,根据这两种标志物对患者进行分层进:如图3所示,TIGIT+/PD-L1+亚组(16例)的确认ORR达75.0%(12例),显著高于其他亚组(TIGIT+/PD-L1-:0/2例;TIGIT-/PD-L1+:5/12例,41.7%;TIGIT-/PD-L1-:4/10例,40.0%)。所有3例完全缓解患者均属TIGIT+/PD-L1+亚组。确认的ORR在不同病理分型中,肝内胆管癌(ICC)为37.5%(12/32例),胆囊癌(GBC)为100%(8/8例),肝外胆管癌(ECC)为100%(1/1例)。
生存分析
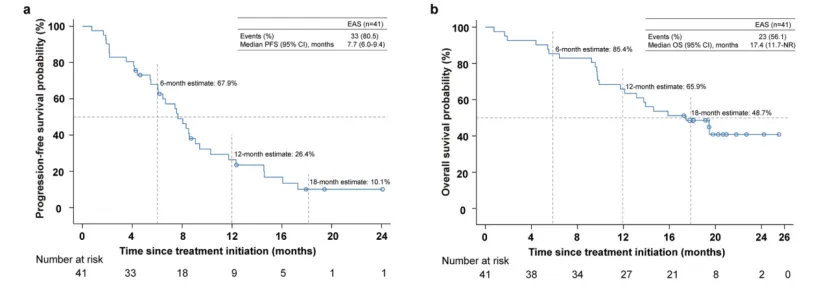
数据截止时(2024年7月19日),33例患者获得PFS。中位随访时间14.6个月,中位PFS为7.7个月(95%CI:6.0~9.4),12个月PFS率为26.4%(95%CI:13.5~41.3,图4a)。数据截止时,23例(56.1%)患者死亡。中位OS为17.4个月(95%CI:11.7~未达到),12个月OS率为65.9%(95%CI:49.3~78.2%,图4b)。
按TIGIT/PD-L1状态进一步分层评估PFS和OS结果:TIGIT+患者的中位PFS为8.3个月,中位OS为NR;而TIGIT-患者中位PFS和OS则分别为7.4个月和12.9个月。对于PD-L1+与PD-L1-患者,中位 PFS分别为8.3个月和 7.0个月,中位OS分别为19.5个月和13.8 个月。
当将TIGIT和PD-L1状态作为组合因素进行分析时:TIGIT+/PD-L1+亚组的中位PFS为9.4个月,OS未达到;而TIGIT+/PD-L1-亚组的中位PFS和OS分别为5.9个月和8.1个月,TIGIT-/PD-L1+为7.7个月和10.8个月,TIGIT-/PD-L1-为7.0个月和16.7个月。
安全性分析
所有患者(100.0%)均发生至少1次治疗相关不良事件(TRAE),其中97.8%(44例)出现治疗相关AEs。≥3级TRAE发生率为60.0%(27例),常见≥3级AEs为中性粒细胞减少(13例,28.9%)、白细胞减少(12例,26.7%)、血小板减少(8例,17.8%)和贫血(6例,13.3%)。45例患者中有11例 (24.4%) 出现严重不良事件 (SAE),其中7例 (15.6%) 出现治疗相关SAE。TRAE导致7例患者(15.6%)停止化疗,3例患者(6.7%)停止免疫治疗。3 例患者(6.7%)出现导致死亡的TEAE,但均未被认为与治疗相关。
免疫相关AEs发生率为42.2%(19例),常见为皮疹/皮炎(20.0%)、甲状腺功能减退(8.9%)和肌钙蛋白T升高(8.9%)。≥3级免疫相关AEs发生率为11.1%(5例),包括皮疹/皮炎(2例,4.4%)、肌酸激酶升高(1例,2.2%)、血小板减少(1例,2.2%)、自身免疫性心肌炎(1例,2.2%)和血栓形成(1例,2.2%)。
研究分析与总结
ZSAB-TOP研究是首个评估在PD-1抑制剂与吉西他滨-顺铂(GemCis)标准联合方案基础上,添加TIGIT抑制剂治疗晚期BTC疗效与安全性的研究。结果显示,欧司珀利单抗、替雷利珠单抗与GemCis的三药联合方案,ORR达到51.2%,显著高于GemCis历史对照的25%(P=0.0003)。该方案的中位OS达17.4个月,提示肿瘤缓解可能带来长期生存获益。此外,双重免疫治疗联合GemCis的安全性可控,≥3级TRAEs发生率为60.0%。
全球Ⅲ期KEYNOTE-966和TOPAZ-1试验已确立帕博利珠单抗或度伐利尤单抗联合GemCis作为新的一线标准,但其ORR仅较GemCis略有提升(分别为26.7%和29.0%),进一步凸显ZSAB-TOP研究中添加欧司珀利单抗后ORR改善的显著意义。此外,本研究OS达17.4个月,数值上长于度伐利尤单抗或帕博利珠单抗联合GemCis的12.7~12.8个月。但需注意,由于试验设计差异(如患者基线特征不同),此类跨试验比较需谨慎。具体而言,ZSAB-TOP研究纳入患者中位年龄更低、ECOG评分更优、转移性疾病比例更少,提示可能纳入更年轻、体能状态更好的低疾病负担人群。尽管如此,鼓舞人心的疗效和生存数据仍支持该方案在晚期BTC中的潜在价值,需进一步验证。
除试验间差异外,疗效提升的可能机制之一在于免疫方案中新增了TIGIT抑制。首先,TIGIT抑制剂可直接调控免疫介导的抗肿瘤活性。其次,TIGIT对肿瘤微环境具有间接抑制作用。最后,TIGIT抑制剂与PD-1/PD-L1阻断剂具有协同作用。总体而言,TIGIT抑制剂可通过阻断TIGIT信号通路,增强NK/T细胞的抗肿瘤活性。ZSAB-TOP研究中,PFS数值上与KEYNOTE-966及TOPAZ-1试验相当,可能与BTC患者PFS评估的复杂性有关——该人群的疾病进展评估常依赖非影像学指标(如血清糖类抗原19-9水平、肝功能及胆道梗阻情况),因此基于RECIST 1.1标准的PFS可能无法完全反映真实疾病进展。
鉴于PD-1/PD-L1与TIGIT在BTC浸润CD8+ T细胞中均高表达,双重免疫治疗在该疾病中值得探索。前期研究也发现,ICC患者中,TIGIT与PD-L1双阳性与更差的OS相关(复旦大学附属中山医院未发表数据),提示抗TIGIT与抗PD-L1联合治疗可能是ICC的潜在有效策略。本研究支持这一假设:TIGIT+或PD-L1+患者的确认ORR、PFS及OS均数值更高,尤以双阳性患者为著(ORR 75.0%)。值得注意的是,所有确认CR的患者均属TIGIT+/PD-L1+亚组。与既往报道一致,本研究中90%的TIGIT阳性患者同时为PD-L1阳性。总体而言,TIGIT与PD-L1共表达可能有助于识别BTC中更易从双抑制剂联合化疗中获益的人群,这还需进一步研究确认。目前,多项针对BTC的PD-1与TIGIT双重阻断Ⅲ期试验(NCT06467357、NCT06109779)正在进行,或将为该联合策略提供更多依据。
晚期BTC研究常合并分析不同病理亚型,但各亚型的治疗反应与预后存在差异,需深入探讨。KEYNOTE-966与TOPAZ-1试验的亚组分析显示,免疫治疗联合化疗在ICC、ECC、GBC亚组中的疗效相当。而本研究中,GBC和ECC患者的肿瘤反应更优:所有GBC(8例)和ECC(1例)患者均达到客观缓解,而ICC患者的ORR为37.5%。有趣的是,GBC和ECC患者中TIGIT/PD-L1双阳性比例更高(GBC 75.0%、ECC 100%),而ICC患者中仅28.1%为双阳性。尽管受限于样本量,该结果提示GBC和ECC亚型中TIGIT与PD-L1更易共表达,且双重阻断可能在此类亚型中产生协同增效。未来需进一步探索各亚型中TIGIT/PD-L1的表达模式及双抑制剂联合化疗的疗效。
安全性方面,替雷利珠单抗、欧司珀利单抗与GemCis的三药联合方案安全性可控,≥3级TRAEs发生率为60.0%,与TOPAZ-1(62.7%)和KEYNOTE-966(70.0%)试验相当。多数不良事件可通过暂停给药或对症支持治疗控制,未发生治疗相关死亡。此外,42.2%的患者出现免疫相关不良事件,与TIGIT和PD-L1抑制剂联合治疗的既往报道(21.9%~54.4%)相当。多数免疫相关不良事件为1~2级,无新发安全性信号。仅3例(6.7%)患者因TRAEs停用免疫治疗。总体而言,该方案在晚期BTC中的安全性可接受,未增加≥3级TRAEs或治疗中断的发生率。
综上,替雷利珠单抗联合欧司珀利单抗及GemCis方案在晚期BTC中展现出令人鼓舞的抗肿瘤活性和生存获益,且安全性可控。该组合策略有望成为晚期BTC新的潜在一线治疗选择,未来仍需通过大规模Ⅲ期随机对照试验进行前瞻性验证,以指导临床实践。
参考文献:[1] Shi, G., Huang, X., Ma, L. et al. First-line tislelizumab and ociperlimab combined with gemcitabine and cisplatin in advanced biliary tract cancer (ZSAB-TOP): a multicenter, single-arm, phase 2 study. Sig Transduct Target Ther 10, 260 (2025). https://doi.org/10.1038/s41392-025-02356-y
晚期胆道癌(BTC)因起病隐匿、治疗手段有限,患者预后长期不佳,中位总生存期(OS)不足一年。尽管PD-1/PD-L1抑制剂联合化疗已成为一线标准,但客观缓解率(ORR)提升有限,亟需更高效的联合方案。既往有研究表明,PD-1/PD-L1与TIGIT双重抑制可能通过协同作用增强抗肿瘤效果。
2025年8月21日,复旦大学附属中山医院樊嘉院士、周俭教授、施国明教授团队在Signal Transduction and Targeted Therapy(STTT,IF=52.7)发表ZSAB-TOP研究结果。这项多中心、单臂、Ⅱ期临床试验(NCT050231109)首次评估了替雷利珠单抗(PD-1抑制剂)+欧司珀利单抗(TIGIT抑制剂)联合吉西他滨-顺铂(GemCis)方案治疗晚期BTC的疗效与安全性。符合条件的患者采用三药联合方案:每21天周期中,替雷利珠单抗(200 mg)和欧司珀利单抗(900 mg)于第1天给药,直至不可耐受毒性或疾病进展,同时吉西他滨(1000 mg/m2)和顺铂(25 mg/m2)于第1、8天给药,最多8个周期。主要终点为研究者评估的确认ORR。本次研究结果首次验证了PD-1/TIGIT双靶点阻断联合化疗的有效性,填补了国际空白,为无法手术的晚期BTC患者提供了新选择。尽管需Ⅲ期试验进一步验证,这一成果仍为一线治疗开辟了新方向,有望改写临床指南,彰显我国学者在肿瘤免疫联合治疗领域的创新实力。现本文对研究关键内容进行了整理,以飨读者。
研究结果
患者特征
2022年3月8日~2023年1月18日期间,研究共纳入45例患者并进入安全性分析集(SAS,图1)。患者中位年龄58.0岁,男性占55.6%。多数患者为TNM分期Ⅳ期(31例,68.9%),病灶起源于肝内(34例,75.6%),且60.0%存在转移性疾病。
44例(97.8%)患者完成TIGIT和PD-L1表达水平检测,具体分布为:TIGIT+/PD-L1+(18例,40.0%)、TIGIT+/PD-L1-(2例,4.4%)、TIGIT-/PD-L1+(13例,28.9%)、TIGIT-/PD-L1-(11例,24.4%)。
疗效分析
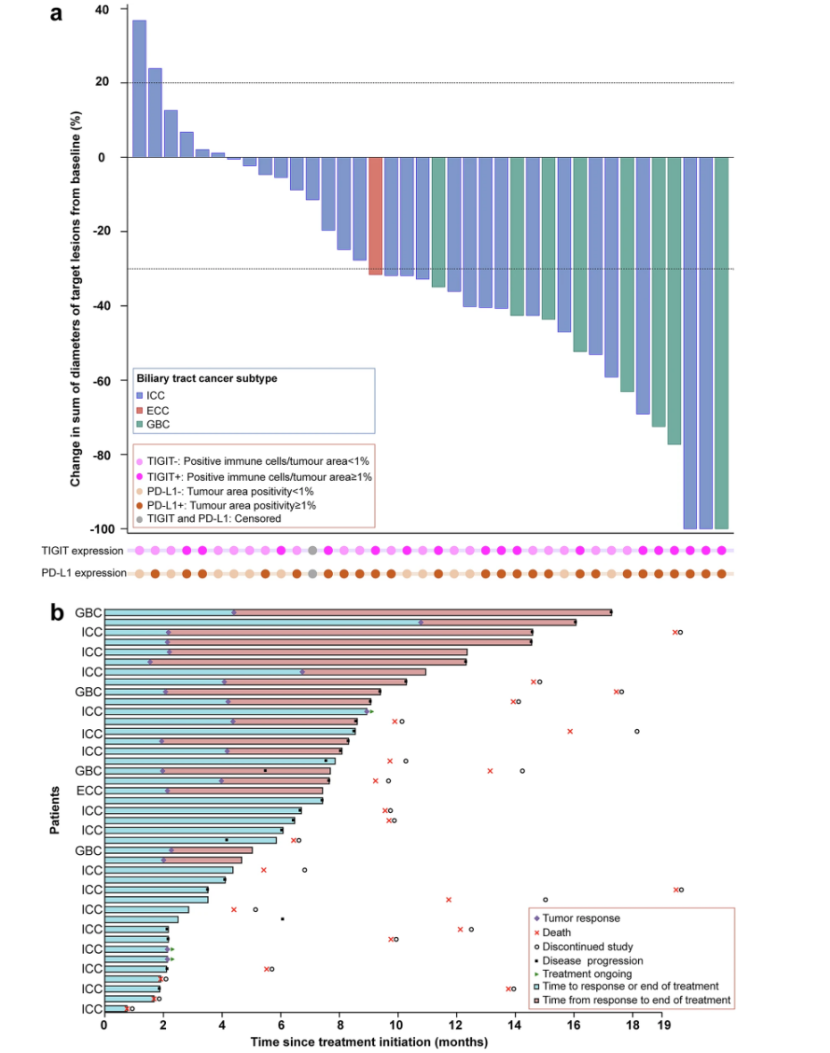
在疗效分析集(EAS,41例)中,研究者评估的确认ORR为51.2%(21/41例;95%CI:35.1~67.1),包含3例完全缓解(CR)和18例部分缓解(PR,图2a),达到统计学优效性标准(P=0.0003)。疾病控制率(DCR)为82.9%(34/41例;95%CI:67.9~92.8),13例患者病情稳定(SD,包括2例未确认的PR)。在23例达到CR或PR(含2例未确认PR)的患者中,中位缓解持续时间(DoR)为6.4个月(95%CI:4.2~12.5)。EAS所有患者的治疗时间如图2b所示。3例(7.3%)患者经治疗后肿瘤显著缩小,符合手术指征并接受根治性手术。
亚组分析
TIGIT+(12/18例,66.7%)或PD-L1+(17/28例,60.7%)患者的确认ORR高于TIGIT-(9/22例,40.9%)或PD-L1-(4/12例,33.3%)。为了进一步探索TIGIT和PD-L1状态的综合影响,根据这两种标志物对患者进行分层进:如图3所示,TIGIT+/PD-L1+亚组(16例)的确认ORR达75.0%(12例),显著高于其他亚组(TIGIT+/PD-L1-:0/2例;TIGIT-/PD-L1+:5/12例,41.7%;TIGIT-/PD-L1-:4/10例,40.0%)。所有3例完全缓解患者均属TIGIT+/PD-L1+亚组。确认的ORR在不同病理分型中,肝内胆管癌(ICC)为37.5%(12/32例),胆囊癌(GBC)为100%(8/8例),肝外胆管癌(ECC)为100%(1/1例)。
生存分析
数据截止时(2024年7月19日),33例患者获得PFS。中位随访时间14.6个月,中位PFS为7.7个月(95%CI:6.0~9.4),12个月PFS率为26.4%(95%CI:13.5~41.3,图4a)。数据截止时,23例(56.1%)患者死亡。中位OS为17.4个月(95%CI:11.7~未达到),12个月OS率为65.9%(95%CI:49.3~78.2%,图4b)。
按TIGIT/PD-L1状态进一步分层评估PFS和OS结果:TIGIT+患者的中位PFS为8.3个月,中位OS为NR;而TIGIT-患者中位PFS和OS则分别为7.4个月和12.9个月。对于PD-L1+与PD-L1-患者,中位 PFS分别为8.3个月和 7.0个月,中位OS分别为19.5个月和13.8 个月。
当将TIGIT和PD-L1状态作为组合因素进行分析时:TIGIT+/PD-L1+亚组的中位PFS为9.4个月,OS未达到;而TIGIT+/PD-L1-亚组的中位PFS和OS分别为5.9个月和8.1个月,TIGIT-/PD-L1+为7.7个月和10.8个月,TIGIT-/PD-L1-为7.0个月和16.7个月。
安全性分析
所有患者(100.0%)均发生至少1次治疗相关不良事件(TRAE),其中97.8%(44例)出现治疗相关AEs。≥3级TRAE发生率为60.0%(27例),常见≥3级AEs为中性粒细胞减少(13例,28.9%)、白细胞减少(12例,26.7%)、血小板减少(8例,17.8%)和贫血(6例,13.3%)。45例患者中有11例 (24.4%) 出现严重不良事件 (SAE),其中7例 (15.6%) 出现治疗相关SAE。TRAE导致7例患者(15.6%)停止化疗,3例患者(6.7%)停止免疫治疗。3 例患者(6.7%)出现导致死亡的TEAE,但均未被认为与治疗相关。
免疫相关AEs发生率为42.2%(19例),常见为皮疹/皮炎(20.0%)、甲状腺功能减退(8.9%)和肌钙蛋白T升高(8.9%)。≥3级免疫相关AEs发生率为11.1%(5例),包括皮疹/皮炎(2例,4.4%)、肌酸激酶升高(1例,2.2%)、血小板减少(1例,2.2%)、自身免疫性心肌炎(1例,2.2%)和血栓形成(1例,2.2%)。
研究分析与总结
ZSAB-TOP研究是首个评估在PD-1抑制剂与吉西他滨-顺铂(GemCis)标准联合方案基础上,添加TIGIT抑制剂治疗晚期BTC疗效与安全性的研究。结果显示,欧司珀利单抗、替雷利珠单抗与GemCis的三药联合方案,ORR达到51.2%,显著高于GemCis历史对照的25%(P=0.0003)。该方案的中位OS达17.4个月,提示肿瘤缓解可能带来长期生存获益。此外,双重免疫治疗联合GemCis的安全性可控,≥3级TRAEs发生率为60.0%。
全球Ⅲ期KEYNOTE-966和TOPAZ-1试验已确立帕博利珠单抗或度伐利尤单抗联合GemCis作为新的一线标准,但其ORR仅较GemCis略有提升(分别为26.7%和29.0%),进一步凸显ZSAB-TOP研究中添加欧司珀利单抗后ORR改善的显著意义。此外,本研究OS达17.4个月,数值上长于度伐利尤单抗或帕博利珠单抗联合GemCis的12.7~12.8个月。但需注意,由于试验设计差异(如患者基线特征不同),此类跨试验比较需谨慎。具体而言,ZSAB-TOP研究纳入患者中位年龄更低、ECOG评分更优、转移性疾病比例更少,提示可能纳入更年轻、体能状态更好的低疾病负担人群。尽管如此,鼓舞人心的疗效和生存数据仍支持该方案在晚期BTC中的潜在价值,需进一步验证。
除试验间差异外,疗效提升的可能机制之一在于免疫方案中新增了TIGIT抑制。首先,TIGIT抑制剂可直接调控免疫介导的抗肿瘤活性。其次,TIGIT对肿瘤微环境具有间接抑制作用。最后,TIGIT抑制剂与PD-1/PD-L1阻断剂具有协同作用。总体而言,TIGIT抑制剂可通过阻断TIGIT信号通路,增强NK/T细胞的抗肿瘤活性。ZSAB-TOP研究中,PFS数值上与KEYNOTE-966及TOPAZ-1试验相当,可能与BTC患者PFS评估的复杂性有关——该人群的疾病进展评估常依赖非影像学指标(如血清糖类抗原19-9水平、肝功能及胆道梗阻情况),因此基于RECIST 1.1标准的PFS可能无法完全反映真实疾病进展。
鉴于PD-1/PD-L1与TIGIT在BTC浸润CD8+ T细胞中均高表达,双重免疫治疗在该疾病中值得探索。前期研究也发现,ICC患者中,TIGIT与PD-L1双阳性与更差的OS相关(复旦大学附属中山医院未发表数据),提示抗TIGIT与抗PD-L1联合治疗可能是ICC的潜在有效策略。本研究支持这一假设:TIGIT+或PD-L1+患者的确认ORR、PFS及OS均数值更高,尤以双阳性患者为著(ORR 75.0%)。值得注意的是,所有确认CR的患者均属TIGIT+/PD-L1+亚组。与既往报道一致,本研究中90%的TIGIT阳性患者同时为PD-L1阳性。总体而言,TIGIT与PD-L1共表达可能有助于识别BTC中更易从双抑制剂联合化疗中获益的人群,这还需进一步研究确认。目前,多项针对BTC的PD-1与TIGIT双重阻断Ⅲ期试验(NCT06467357、NCT06109779)正在进行,或将为该联合策略提供更多依据。
晚期BTC研究常合并分析不同病理亚型,但各亚型的治疗反应与预后存在差异,需深入探讨。KEYNOTE-966与TOPAZ-1试验的亚组分析显示,免疫治疗联合化疗在ICC、ECC、GBC亚组中的疗效相当。而本研究中,GBC和ECC患者的肿瘤反应更优:所有GBC(8例)和ECC(1例)患者均达到客观缓解,而ICC患者的ORR为37.5%。有趣的是,GBC和ECC患者中TIGIT/PD-L1双阳性比例更高(GBC 75.0%、ECC 100%),而ICC患者中仅28.1%为双阳性。尽管受限于样本量,该结果提示GBC和ECC亚型中TIGIT与PD-L1更易共表达,且双重阻断可能在此类亚型中产生协同增效。未来需进一步探索各亚型中TIGIT/PD-L1的表达模式及双抑制剂联合化疗的疗效。
安全性方面,替雷利珠单抗、欧司珀利单抗与GemCis的三药联合方案安全性可控,≥3级TRAEs发生率为60.0%,与TOPAZ-1(62.7%)和KEYNOTE-966(70.0%)试验相当。多数不良事件可通过暂停给药或对症支持治疗控制,未发生治疗相关死亡。此外,42.2%的患者出现免疫相关不良事件,与TIGIT和PD-L1抑制剂联合治疗的既往报道(21.9%~54.4%)相当。多数免疫相关不良事件为1~2级,无新发安全性信号。仅3例(6.7%)患者因TRAEs停用免疫治疗。总体而言,该方案在晚期BTC中的安全性可接受,未增加≥3级TRAEs或治疗中断的发生率。
综上,替雷利珠单抗联合欧司珀利单抗及GemCis方案在晚期BTC中展现出令人鼓舞的抗肿瘤活性和生存获益,且安全性可控。该组合策略有望成为晚期BTC新的潜在一线治疗选择,未来仍需通过大规模Ⅲ期随机对照试验进行前瞻性验证,以指导临床实践。
参考文献:[1] Shi, G., Huang, X., Ma, L. et al. First-line tislelizumab and ociperlimab combined with gemcitabine and cisplatin in advanced biliary tract cancer (ZSAB-TOP): a multicenter, single-arm, phase 2 study. Sig Transduct Target Ther 10, 260 (2025). https://doi.org/10.1038/s41392-025-02356-y
- 推荐文章
高危胃肠道间质瘤(GIST)术后辅助治疗的五大争议与决策
胃食管交界部癌的多模式治疗:现状与未来方向丨2025韩国国际胃癌周
Jeeyun Lee教授解析多组学技术如何重塑胃癌免疫微环境丨2025韩国国际胃癌周
王绿化教授解析食管癌临床研究新进展:免疫治疗引领格局变革,中国原创方案重塑国际标准丨CSCO 2025
Nature Medicine丨AI赋能结直肠癌手术:个性化围手术期治疗的临床突破与未来方向
Joo Ha Hwang教授详解胃癌一、二级预防全球行动丨2025韩国国际胃癌周
食管鳞癌新辅助治疗迎来新突破!化免方案VS放化疗,生存、复发数据全面对比
李健教授:探索胃肠间质瘤联合治疗新策略,攻克TKIs耐药难关丨CACA东北整合肿瘤学大会 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025-09-30 19:15:32 河北 手机阅读
共探胃癌诊疗新路径!2025韩国国际胃癌周中韩专场顺利举办,四大前沿研究擘画治疗未来
CACA东北整合肿瘤学大会丨徐泽宽教授:精准治疗时代胃癌诊疗机遇和挑战并存
应杰儿教授:以“整合”破局胃癌诊疗难题,以“康复”守护患者长期预后丨2025CACA东北整合肿瘤学大会
王峰教授展望未来食管癌精准免疫治疗新策略丨CSCO名家演讲集
ESMO 2025丨LBA重磅发布,消化道肿瘤领域最新进展一文纵览!
王峰教授:食管癌免疫治疗2.0时代:新联合策略+耐药探索丨CSCO名家演讲集
CACA东北整合肿瘤学大会丨李茂全教授:建立“诊、治、康、护、养”完整诊疗体系,推动胰腺癌个体化和规范化诊疗 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025年9月25日 18:20
聚焦胃癌肝转移诊疗新进展:陈凛教授解析外科价值与多学科协作策略丨2025CACA东北整合肿瘤学大会
国际视角丨年轻人注意!早发性癌症发病率上升,肥胖和代谢差可能是“关键推手”
CSCO 2025丨吴胤瑛教授深度解读神经内分泌瘤诊疗指南更新,破局副神经节瘤精准诊疗新纪元
CSCO 2025丨方维佳教授详解肝癌围手术期免疫治疗新进展,这些突破值得关注!
CSCO 2025丨钱浩然主任医师解读高危GIST术后辅助治疗指南推荐与五大争议热点的破局之道
CSCO 2025丨王理伟教授解析晚期胰腺癌新药研究进展,精准治疗开启多靶点探索新时代
CSCO 2025丨邓艳红教授:结直肠癌中FOLFOXIRI三药方案临床应用进展
“瘤瘤”新知丨真实世界研究表明风险分层工具可提高上消化道肿瘤检出率
CSCO 2025丨项晓军教授:免疫治疗重塑胃癌“慢病化”全程管理新范式
岂有此“例”丨一例CLDN18.2阳性晚期胃癌患者接受含佐妥昔单抗治疗后出现胃炎的病例分析
CSCO名家视点丨李恩孝教授:胆道恶性肿瘤中国专家共识发布,加速我国胆道肿瘤诊疗规范化和精准化进程
CSCO 2025丨从“千人一方”到“量体裁衣",唐勇教授揭秘胃癌免疫治疗的精准标尺与分层策略
CSCO 2025丨勾红峰教授:免疫治疗时代下局部进展期胃癌诊治策略革新,豁免手术或成为可能
国际视角丨KRAS G12C突变结直肠癌最新进展:联合疗法开启治疗新纪元
术前贫血对直肠癌保肛手术近期及远期疗效有哪些影响?一项回顾性研究揭晓答案
革故鼎新,步召德教授详解直肠癌新辅助治疗的进展、挑战与未来变革|华夏结直肠病学论坛
利用真实世界数据提升临床试验结果普适性:一项前瞻性研究带来的洞见
杨林教授解读结直肠癌免疫治疗进展:精准分层与动态监测是未来方向|华夏结直肠病学论坛
沈琳教授团队:非V600E BRAF突变转移性结直肠癌的持续挑战与前沿治疗策略
华夏结直肠病学论坛丨孙立峰教授:聚焦结直肠癌腹膜转移个体化和精准化治疗策略
素食防癌再添实锤!最新研究表明吃素可降低癌症风险
“瘤瘤”新知丨AI导致内镜医师技能退化?《柳叶刀》研究揭示医疗AI的双刃剑效应
“冷肿瘤”破局之道:胡志前教授解读MSS型结直肠癌免疫治疗困境及探索|华夏结直肠病学论坛
岂有此“例”丨从脂肪肝到肝癌——一例MASH相关肝细胞癌的长期管理与成功移植
老年Ⅱ~Ⅲ期结直肠癌患者能否从奥沙利铂辅助化疗中获益?大型回顾性研究为您答疑解惑
血液or组织?转移性结直肠癌生物标志物检测最佳标本如何选择
谋“防”重“治”,毛友生教授详解中国食管癌防治优化之路与青年医师培养新策|2025CACA华中整合肿瘤学大会
心灵驿站丨生与死的奇妙共舞
肿瘤学年鉴:BFR14长期随访结果表明,13% GIST患者生存超过20年!
晚期HCC生存与生活质量兼得的治疗方案是什么?这项荟萃分析给出提示
多学科协同筑基石,创新实践领前沿——交大一附院李恩孝教授团队胃癌诊疗之路探微
令人鼓舞!PD-1联合基于短程放疗的TNT使pMMR局部晚期直肠癌CR率近翻倍
谋“效”思“变”,王峰教授阐述食管癌免疫治疗时代下的生存之变与未来之策|2025CACA华中整合肿瘤学大会
大数据揭示!男性肝硬化患者肝癌风险是女性的2倍
主席说丨西北地区胃癌诊疗经验与探索:从差异中寻共识,以协作促发展
樊嘉院士团队最新突破性研究成果见刊STTT:双免联合化疗或为晚期BTC一线治疗开辟新方向,有望改写临床实践指南
全程、精准、以人为本,陈小兵教授畅谈食管癌整合诊疗新范式|2025CACA华中整合肿瘤学大会
量体裁衣,居来提教授详解食管癌不同分期的MDT“排兵布阵”与功能保留之道|2025CACA华中整合肿瘤学大会
国际视角丨知名肿瘤专家为您解析2025年胆道癌治疗现状
“瘤瘤”新知丨多吃十字花科蔬菜可以降低结直肠癌的风险
