- 首页 > 正文
CSCO 2025丨方维佳教授详解肝癌围手术期免疫治疗新进展,这些突破值得关注!
发表时间:2026-01-30 00:15:35
专家简介

方维佳教授 浙江大学第一附属医院 浙大一院、主任医师、博士生导师、肿瘤内科(三)主任 Google h-index 39 i10-index 79 研究方向:实体瘤创新细胞治疗临床与转化研究 研究成果:主持实体瘤细胞治疗注册与IIT临床研究10余项,入组病人逾170例;主持国家基金面上项目2项,科技部重点研发子课题2项,2030重大项目子课题骨干2项,浙江省重点研发3项,在Molecular Therapy, Cell Rep Med, J Immunother Cancer等期刊发表论文20余篇,2023年ESMO Mini Oral, 2024年ASCO Rapid ?Oral 国家卫健委能力建设及继教肿瘤专委会 委员 中国临床肿瘤学会 理事 希思科临床肿瘤学研究基金会 理事 中国临床肿瘤学会肝癌专委会 副主委 中国药促会抗肿瘤药物临床研究专委会 常委 中国临床肿瘤学会胆道肿瘤专委会 常委 中国临床肿瘤学会放射介入专委会 常委 中国临床肿瘤学会老年肿瘤防治专委会 常委 中国医师协会肿瘤医师分会 委员 中国医师协会多学科综合治疗专委会 委员 浙江省可持续发展研究会医疗专委会 委员 浙江省医学会肿瘤化疗与生物治疗学分会 副主委 浙江省医师协会循证医学专委会 副主委 浙江省抗癌协会整合肿瘤专委会 副主委 临床肿瘤学杂志 常务编委 香港大学 访问学者 美国印第安纳大学 访问学者
一、先识“复发规律”:肝癌术后复发呈“双高峰”,早期复发患者预后更差
要优化肝癌围手术期治疗策略,首先需明确术后复发的特征与风险。东方肝胆外科医院沈锋教授团队开展的一项前瞻性、观察性研究[1],纳入894例接受手术切除的肝细胞癌(HCC)患者,其结果为我们揭示了肝癌术后复发的关键规律。首先,复发时间呈“双高峰”分布(图1左)。研究数据显示,肝癌患者术后1~2年将迎来第一个复发高峰,此后复发率逐渐下降;但在术后2~3年复发率再次上升,并于术后4~5年出现第二个复发高峰。这一“双高峰”特征提示,肝癌术后需长期随访监测,且不同阶段的复发风险可能与肿瘤生物学特性、残留微小病灶状态等因素相关。其次,早期复发患者生存预后显著更差(图1右)。根据复发时间,研究将患者分为早期复发(≤2年)、晚期复发(>2年)与无复发三组。结果显示,早期复发患者的总体生存期(OS)显著差于无复发和晚期复发患者(所有P<0.001); 从复发后生存期(PRS)来看,早期复发患者的PRS仅为19.1个月,远低于晚期复发患者的37.5个月(P<0.001)。 这一结果强调,降低早期复发风险是改善肝癌术后患者生存的核心目标,而围手术期干预(如新辅助治疗减少微小病灶、辅助治疗抑制残留肿瘤细胞)可能成为关键突破口。
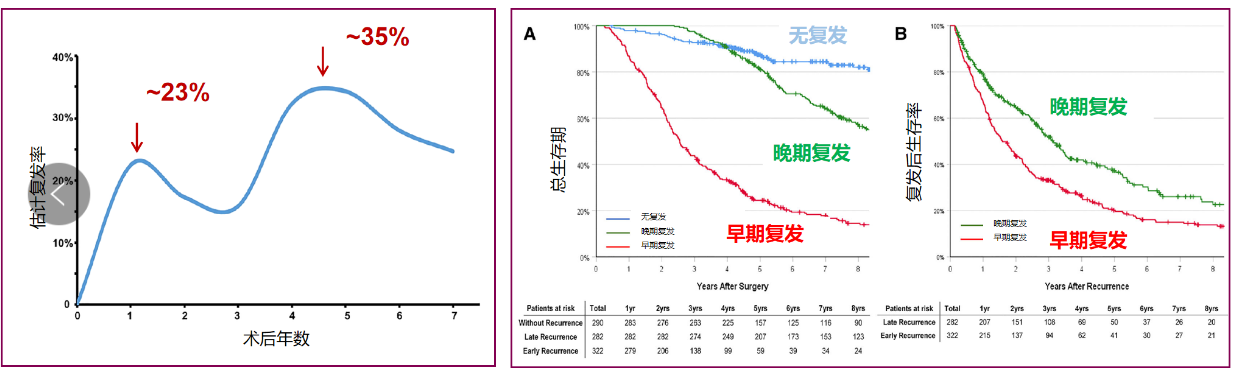
图1. 术后复发率(左);复发与总生存期(右)
二、突破“切除瓶颈”:转化治疗让“不可切除”肝癌获得手术机会
对于初始肿瘤负荷较大、剩余肝脏体积(FLR)不足或肿瘤位置特殊的“不可切除”肝癌患者,转化治疗的目标是通过系统性治疗或局部治疗,使肿瘤降期、缩小,最终达到手术切除标准。方维佳教授在报告中重点解读了转化治疗的共识原则、核心方案与最新临床数据。
1 转化治疗的核心考量:ORR与安全性并重
《肝癌转化治疗中国专家共识(2021版)》[2]首次完整建立肝癌转化治疗评估体系,明确了转化治疗方案的选择需优先关注客观缓解率(ORR)与缓解质量(包括肿瘤进展率、缓解持续时间、缓解深度),同时需评估药物安全性对后续手术的影响。而2024版共识[3]进一步强调抗血管生成药物联合ICIs是肝癌转化治疗的重要手段(证据等级3,推荐A),且需在多学科团队(MDT)框架下,关注肿瘤缓解的持续时间和缓解程度,密切监测治疗毒性及其对转化手术切除的可能影响。
2 FLR不足患者的转化:ALPPS效率优于PVE
对于因FLR不足无法手术的患者,临床常用门静脉栓塞术(PVE)与联合肝脏分路和门静脉结扎的二步肝切除术(ALPPS)两种方式增加FLR,并且ALPPS较PVE具有较高的转化效率(证据等级2,推荐A,图2)[3]。

图2. ALPPS与PVE的差异
3 创新方案验证:PVL联合“双药”转化成功率达66.7%
彭涛教授团队开展的PLACES研究[4~5],探索了门静脉结扎术(PVL)联合卡瑞利珠单抗(PD-1单抗)+阿帕替尼(TKI)用于FLR不足肝癌患者的转化疗效,其结果令人振奋。该研究是一项单臂前瞻性Ⅱ期研究,入组30例FLR不足患者(伴肝硬化者FLR/SLV<40%,无肝硬化者<30%),先接受PVL,再予卡瑞利珠单抗(200 mg iv q2w)+阿帕替尼(250 mg po qd)治疗,直至达到手术标准后行二期肝切除术,此后给予卡瑞利珠单抗联合阿帕替尼治疗1年或直至方案规定的终点。结果显示,根据mRECIST标准,ORR达40.0%(CR 13.3%+PR 26.7%),66.7%患者的肝肿瘤动脉期强化面积缩小;76.7%患者影像学评估转化成功,最终66.7%完成二期肝切除术。安全性方面,最常见不良事件为低白蛋白血症,且多为1~2级,未显著影响手术安全性。总之,该研究证实,PVL联合“ICIs+TKI”方案可为FLR不足的肝癌患者提供高效、安全的转化路径。
三、优化“围术方案”:新辅助/辅助治疗降低复发,延长生存
除转化治疗外,新辅助治疗(术前)与辅助治疗(术后)是围手术期管理的另外两大核心环节。方维佳教授在报告中解读了多项关键Ⅱ/Ⅲ期研究,为不同风险分层患者的治疗选择提供依据。
1 新辅助治疗:“ICIs+TKI”实现病理缓解,小肿瘤患者获益更显著
夏永祥教授、王学浩院士团队开展的Ⅱ期研究[6],探索了卡瑞利珠单抗+阿帕替尼用于CNLC?Ⅱb/Ⅲa期潜在可切除肝癌患者的新辅助疗效。研究纳入20例患者先接受3周期卡瑞利珠单抗(200 mg q2w)+阿帕替尼(250 mg qd)新辅助治疗,4周内接受肝切除术,术后再予8周期联合辅助治疗。结果显示,共18例患者完成卡瑞利珠单抗联合阿帕替尼术前新辅助治疗。根据RECIST v1.1标准评估,术前ORR为16.7%;根据mRECIST标准,术前ORR达33.3%(图3),66.7%患者肿瘤缩小,肿瘤直径较小的患者更易获得完全病理缓解(pCR),且pCR患者的肿瘤直径显著小于非pCR患者(P<0.05)。此外,在免疫微环境方面,应答病灶(≥50%肿瘤坏死)的CCL13、TNFSF9、IDO1等免疫相关基因表达更高,提示基线免疫微环境状态可能预测治疗应答。
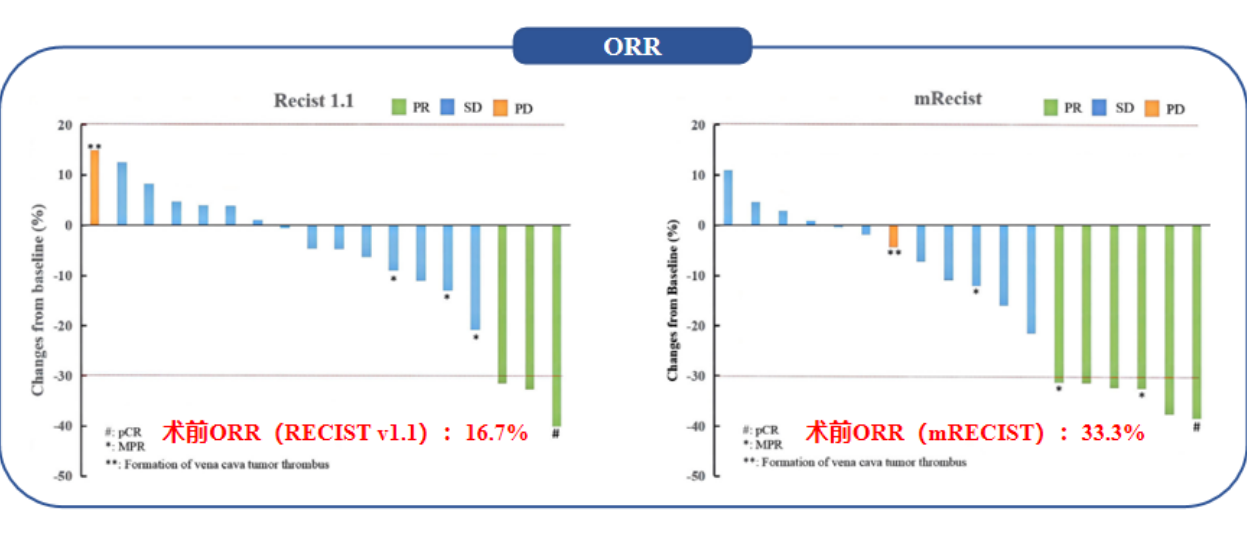
图3. 根据RECIST v1.1标准和mRECIST标准评估的ORR
另一项CAR_HERO研究[7]则针对可切除的多结节性CNLC?Ⅰb/Ⅱa期HCC,对比了不同新辅助方案的疗效。研究入组42例患者,分为A组(2周期卡度尼利单抗)、B组(1次FOLFOX-HAIC+2周期卡度尼利单抗)、C组(1次FOLFOX-HAIC)。结果显示,B组(HAIC+双免疫)的主要病理缓解率(MPR)达78.6%,显著高于A组(35.7%)与C组(27.3%);且新辅助治疗组的中位无复发生存期(mRFS)未达到(NR),显著优于直接手术组的24.7个月(P=0.0018)。?这些研究提示,“局部治疗(HAIC)+免疫治疗”的联合新辅助方案,可能为多结节、中高危肝癌患者带来更优的病理应答与生存获益。
2 辅助治疗:纳武利尤单抗、“Durvalumab+贝伐珠单抗”展现复发防控潜力
对于术后复发高危患者,辅助治疗的目标是抑制残留肿瘤细胞,降低复发风险。两项关键研究为辅助治疗提供了新选择。
NIVOLVE研究(2022 ASCO GI)[8]评估了纳武利尤单抗用于肝癌术后/射频消融(RFA)后辅助治疗的疗效。研究入组55例中高危复发患者(如肿瘤>5 cm、微血管侵犯),予纳武利尤单抗(240 mg q2w×8次,后480 mg q4w×8次)治疗。结果显示,1年无复发生存率(RFS)达78.6%,mRFS为26.3个月,且安全性良好。
Ⅲ期Emerald-2研究(NCT03847428)探索“度伐利尤单抗(PD-L1单抗)+贝伐珠单抗”用于术后辅助治疗的价值,入组888例复发高危患者,分为三组(双药联合、度伐利尤单抗单药、安慰剂);主要终点为RECIST 1.1标准评估的RFS,目前研究正在进行中,结果值得期待。
四、未来方向:精准分层与联合方案探索,推动肝癌围手术期治疗升级
方维佳教授在报告结尾指出,肝癌围手术期免疫治疗已从“单一方案”向“精准分层”迈进,未来需重点关注三大方向:?第一,生物标志物筛选。如ctDNA、免疫微环境基因(如CCL13、IDO1)、树突状细胞(DC)浸润状态等,有望实现“个体化治疗应答预测”;第二,联合方案优化。“ICIs+TKI+局部治疗(HAIC/TACE)”的三联合方案,可能进一步提升ORR与转化成功率,尤其适用于中晚期患者;第三,特殊人群探索。针对合并肝硬化、FLR严重不足等特殊人群,需开发更安全、高效的治疗方案,如iCCA的免疫联合抗纤维化治疗、CAR-T细胞治疗等。
从术后复发规律的精准解析,到转化治疗让“不可切除”变为“可切除”,再到新辅助/辅助治疗降低复发风险,肝癌围手术期免疫治疗已进入“多方案、精准化”时代。方维佳教授在2025 CSCO年会上分享的研究成果,不仅为临床提供了可落地的治疗方案,更指明了未来探索的方向。随着生物标志物研究的深入与联合方案的优化,我们有理由相信,肝癌患者的围手术期管理将不断升级,最终实现“更高切除率、更低复发率、更长生存期”的目标。
参考文献
[1] Ming-Da Wang,et al. Oncologist. 2020 Oct;25(10):e1541-e1551.
[2] 中国抗癌协会肝癌专业委员会转化治疗协作组. 肝癌转化治疗中国专家共识(2021版)[J]. 中国实用外科杂志,2021,41(6):618-632.
[3] 中国抗癌协会肝癌专业委员会转化治疗协作组.原发性肝癌转化及围手术期治疗中国专家共识(2024版)[J].中华消化外科杂志,2024,23(4):492-513.
[4] 2022 AASLD abstract 34744
[5] 2021 ASCO e16132
[6] J Immunother Cancer. 2022 Apr;10(4):e004656
[7] Tao Peng et al. 2025 ASCO Abs#4139.
[8] ?Masatoshi Kudo, et al.2022 ASCO GI Abstraci?#41
- 推荐文章
