- 首页 > 正文
CSCO 2025丨王理伟教授解析晚期胰腺癌新药研究进展,精准治疗开启多靶点探索新时代
发表时间:2026-01-29 23:04:55
胰腺癌因“发病率高、早期诊断难、手术切除率低、死亡率极高”被称为“癌中之王”,中国年发病数占全球1/4,5年生存率仅5%~7%,临床诊疗面临巨大挑战。在2025年中国临床肿瘤学会(CSCO)年会上,上海交通大学医学院附属仁济医院王理伟教授带来晚期胰腺癌新药研究进展报告,从疾病负担、真实世界诊疗现状,到靶向治疗、抗体药物偶联物(ADC)、DNA损伤修复(DDR)通路相关治疗等前沿方向,系统梳理领域突破,为临床实践与未来研究提供关键指引。

王理伟教授
上海交通大学医学院附属仁济医院
肿瘤学二级教授 首席专家 主任医师 博士生导师
MDT专家委员会主任委员/上海交通大学胰腺癌诊治中心主任
国家新药评审专家
中国胰腺病学会常务理事
中国抗癌协会常务理事/整合肿瘤肾脏病专委会主任委员
中国临床肿瘤学会理事/胰腺癌专家委员会首届主任委员
中国医师协会肿瘤医师分会常务委员
中华医学会肿瘤学分会委员兼胰腺肿瘤学组组长
中国临床肿瘤学会胆道肿瘤专家委员会副主任委员
上海市抗癌协会副理事长兼疑难肿瘤专委会主任委员
上海市医学会理事兼肿瘤内科专科分会主任委员
长三角肿瘤专科联盟 会长
上海市领军人才、上海市优秀学科带头人
主要从事消化系统肿瘤临床诊治和转化研究;2001至2004年美国加州大学洛杉矶分校(UCLA)和MD Anderson肿瘤中心访问研究。主持制定了我国首个《胰腺癌综合诊治中国专家共识》、中国临床肿瘤学会首个《CSCO胰腺癌诊疗指南》和首个中国抗癌协会《肿瘤肾脏病保护技术指南》,主持包括自然基金重大研究计划在内的 7项国家自然基金项目、2项重大新药创制项目和10 多项各类基金项目;现为Journal of Pancreatology《肿瘤》副主编、Cancer Research、JHO《临床肿瘤学》等杂志编委,发表SCI论文200余篇,他引2000余次 。获上海医学科技一等奖和华夏医学一等奖。
一、胰腺癌诊疗现状:高疾病负担下,“精准化”与“规范化”任重道远
胰腺癌的“难治性”体现在全病程的诊疗痛点中:2022年全球胰腺癌新增发病51.1万例,中国占比达1/4;诊断时仅15%为可切除早期,60%已处于转移性阶段,而不同分期患者的中位总生存期(mOS)差异显著——早期患者约20~23个月,局部进展期降至9个月,转移性患者仅6个月,5年生存率长期徘徊在5%~7%,改善空间迫切。
为摸清中国晚期胰腺癌诊疗“家底”,王理伟教授团队牵头构建全国最大晚期胰腺癌大数据平台,覆盖50家顶尖三甲医院、2.7万例患者及2亿多条诊疗信息(图1),首次发布的真实世界数据揭示多重问题:1.人群特征特殊:患者男女比6:4,中位发病年龄62岁,而四川省中位发病年龄仅48岁,提示区域差异需关注;2.诊断与检测不足:病理诊断率85.6%、基因检测率5.6%,虽较此前(74.1%、2.5%)有所提升,但基因检测率仍极低,难以支撑精准治疗;3.治疗与指南脱节:辅助治疗、一线治疗方案与指南存在差距,疗效显著低于临床研究数据——患者中位无病生存期(mDFS)7.1个月,一线治疗中位无进展生存期(mPFS)仅4.2个月,规范化诊疗亟待加强。

图1. CPOC中国晚期胰腺肿瘤大数据中心首次数据发布
二、晚期胰腺癌药物研究历程:从化疗到精准,中国力量逐步崛起
胰腺癌药物研究历经多阶段发展:1997~2007年为探索起步期,仅2项成功研究(如1997年Burris研究确立吉西他滨基础地位,2007年厄洛替尼联合吉西他滨方案获批);2007~2013年为加速探索期,新增多项关键研究,如2011年FOLFIRINOX方案(mOS优于吉西他滨)、2013年吉西他滨联合白蛋白紫杉醇(MPACT研究);2013年至今进入精准治疗期,几乎每2年1项突破性研究——2019年POLO研究首次证实奥拉帕利用于胚系BRCA突变患者维持治疗的价值,开启胰腺癌靶向治疗时代;2023年NAPOLI-3研究推出NALIRIFOX方案,2025年PANOVA-3研究探索肿瘤治疗电场(TTFields)联合化疗的潜力,持续丰富治疗选择。
全球胰腺癌研究中,中国贡献度显著提升:从2017年占比10.8%增至2024年35.6%(图2),本土Ⅲ期研究成果突出——如NOTABLE研究(尼妥珠单抗联合吉西他滨)、PAN-HEROIC研究,均基于中国人群数据,为本土患者提供更适配的治疗方案,标志中国胰腺癌研究从“跟跑”向“部分领跑”转变。
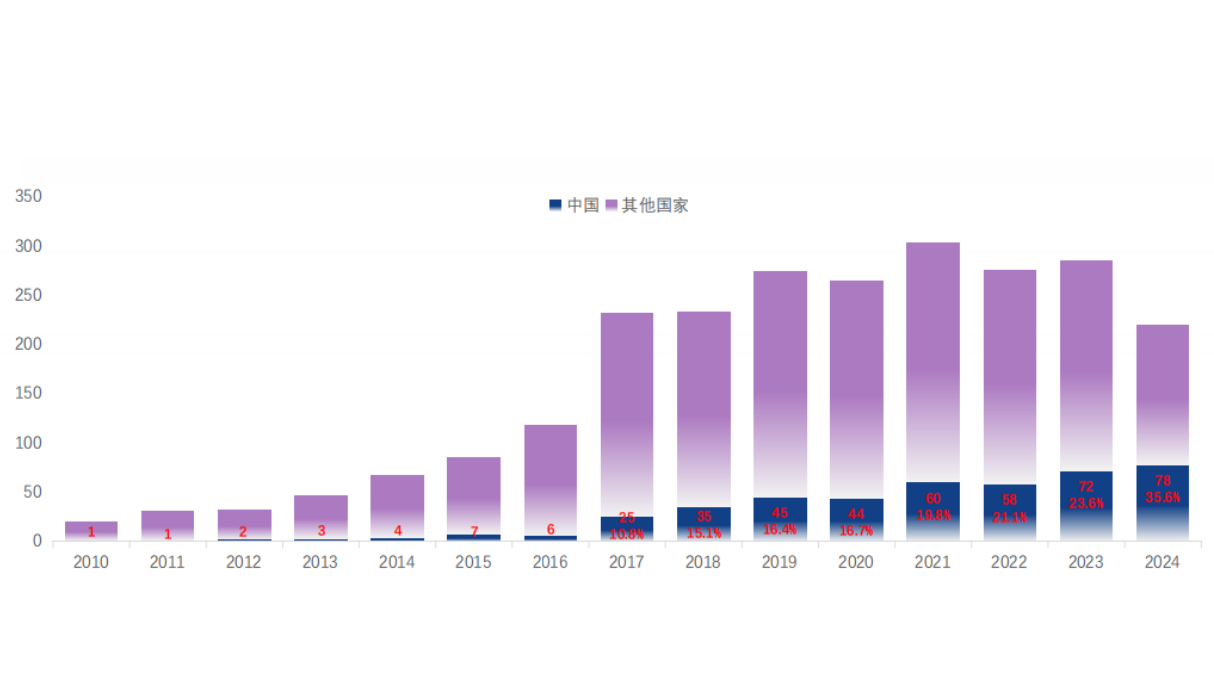
图2. ClinicalTrial Web上登记的胰腺癌药物治疗研究数量统计
三、精准治疗前沿:聚焦KRAS及多靶点,突破“不可成药”壁垒
KRAS是胰腺癌最核心的驱动基因,中国患者突变率约83%(低于欧美90%),且存在野生型与不同突变亚型,需分层应对:
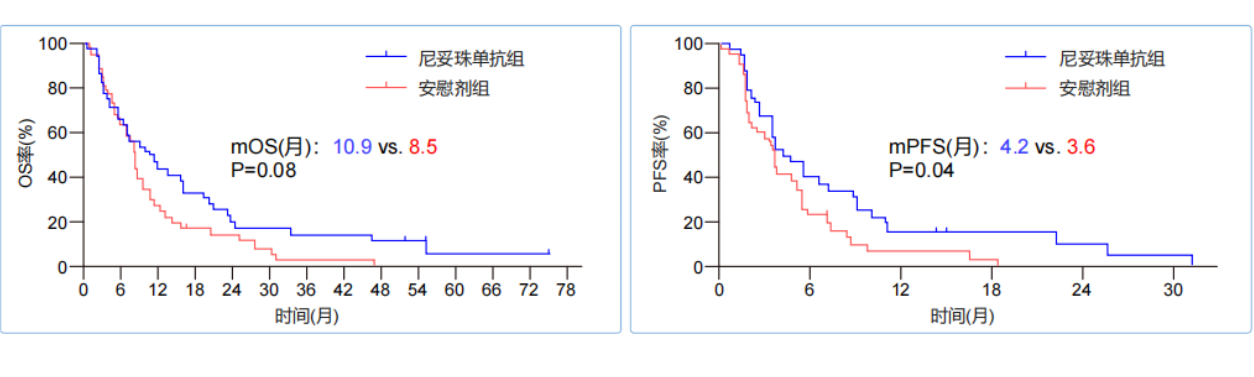 图3. mOS和mPFS
图3. mOS和mPFS
2.KRAS G12C突变:占KRAS突变的2%,已有高选择性抑制剂获批。临床数据显示:Adagrasib治疗12例患者,客观缓解率(ORR)50%、疾病控制率(DCR)100%,mPFS 6.6个月;Sotorasib治疗38例患者,ORR 21%、DCR 84.2%,mPFS 4.0个月。目前中国已上市氟泽雷塞、格索雷塞、戈来雷塞三款KRAS G12C抑制剂,为患者提供更多选择。
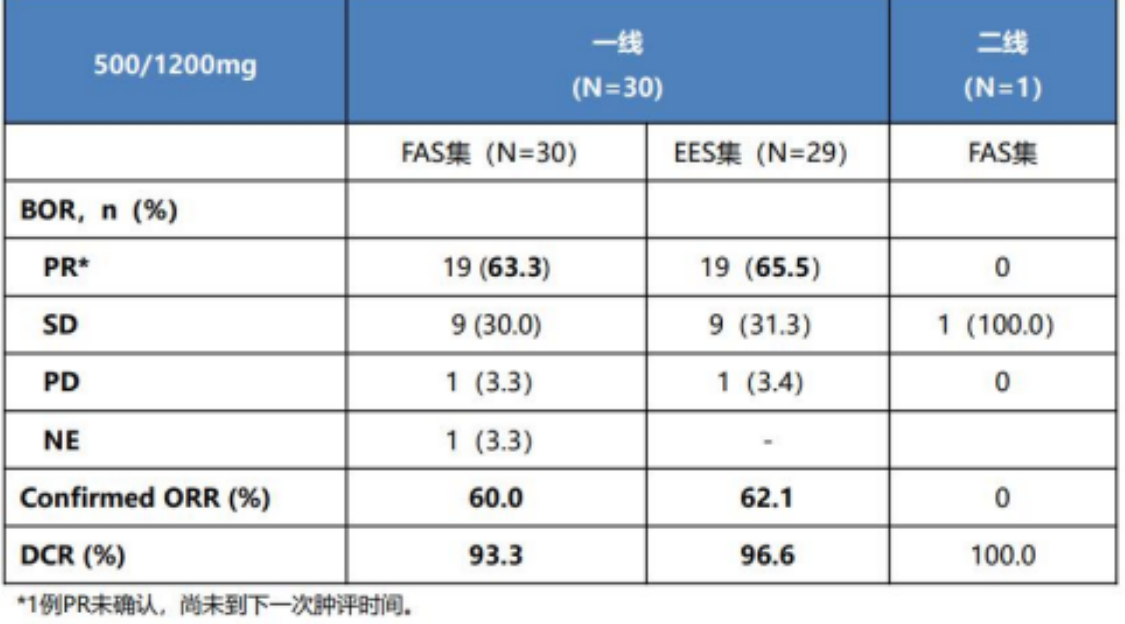
表1. AG+HRS-4642研究者评估的肿瘤缓解情况总结表
4.耐药克服:基础研究发现,KRAS G12D抑制剂MRTX1133能够上调EGFR/HER2表达,而泛ERBB抑制剂阿法替尼可与之协同——胰腺癌小鼠模型显示,阿法替尼联合MRTX1133可显著延长生存期(P<0.05),为临床克服耐药提供新策略。此外,TCR-T细胞治疗也展现潜力:1例71岁胰头癌术后复发伴肺转移患者,接受靶向KRAS G12D的TCR-T治疗后,内脏转移灶缩小72%,6个月后循环T细胞中仍可检测到TCR-T,且无明显毒性。
新兴靶点:TROP2、Claudin18.2、B7-H3 ADC与双抗带来新希望
除KRAS外,TROP2、Claudin18.2、B7-H3等靶点的探索同样取得进展,且以ADC、双抗等新型药物为主:
1.TROP2 ADC(SHR-A1921):新型造影剂显示,TROP2在胰腺癌中高表达,是潜在的治疗靶标。SHR-A1921由抗TROP2抗体、可裂解连接子及拓扑异构酶I抑制剂(9106-IM-2)组成,具有旁观者效应与ADCC活性。I期研究(SHR-A1921-I-101)确定推荐剂量(RP2D)为3.0 mg/kg Q3W,在胰腺癌队列中疗效显著——1例71岁男性胰腺癌肝转移患者,经治疗后达完全缓解(cCR),PFS长达15个月,ECOG PS维持0~1分,安全性良好。
2.Claudin18.2靶向治疗:近60%胰腺导管腺癌(PDAC)患者表达Claudin18.2,双抗与ADC均有突破。Claudin18.2-CD3双抗(IBI389):I期研究纳入72例Claudin18.2 IHC 2/3+≥10%患者,其中Claudin18.2≥40%亚组ORR 38.9%、DCR 66.7%;600μg/kg剂量组3个月PFS率57.1%,且耐受性可控。Claudin18.2 ADC(IBI343):I期剂量扩展队列显示,Claudin18.2+组(n=44)ORR 22.7%、DCR 81.8%,mPFS 5.4个月、mOS 8.5个月,显著优于Claudin18.2-组(ORR 0%、DCR 41.7%、mOS 6.2个月)。
四、DDR通路治疗:基于修复缺陷,优化含铂方案与PARP抑制剂应用
HRD与含铂治疗:突变患者获益更显著
同源重组修复缺陷(HRD)导致肿瘤基因组不稳定,此类患者对含铂化疗更敏感:Meta分析纳入4项研究85例BRCA突变PDAC患者,含铂治疗组mOS 23.7个月,显著优于非含铂组(12.2个月,P<0.001);回顾性分析纳入78例患者中,BRCA/PALB2突变组接受含铂治疗的ORR 58%(非突变组21%,P=0.0022),mPFS 10.1个月(非突变组6.9个月,P=0.0068),mOS 24.6个月(非突变组18.8个月,P=0.0467);真实世界数据(KYT研究)显示,HR-DDR突变患者接受含铂治疗的mOS 2.37年(非突变组1.45年,P<0.0001),且一线含铂治疗获益更显著(mOS 13.7个月 vs. 8.1个月,P=0.0011)。
PARP抑制剂:奥拉帕利开启维持治疗,中国人群提供数据补充
2019年POLO研究确立奥拉帕利在胚系BRCA突变患者中的维持治疗地位:154例一线铂类治疗无进展的患者,接受奥拉帕利维持治疗的mPFS 6.7个月(安慰剂组3.7个月,P=0.0004),虽OS无统计学差异,但显著延缓疾病进展,推动奥拉帕利获FDA批准。
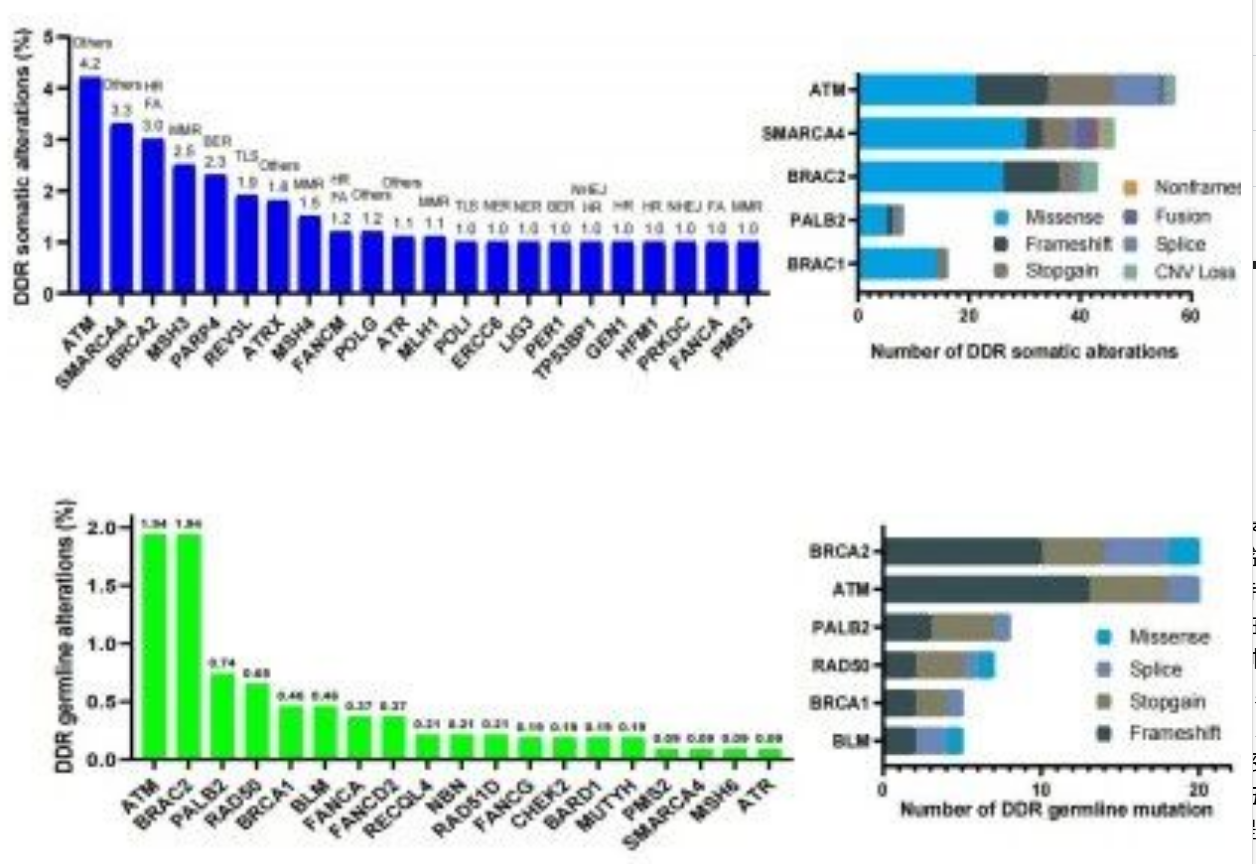
王理伟教授团队针对1080例中国人群胰腺癌DDR特征的回顾性分析显示(图4):约28%胰腺癌患者存在DDR基因体系突变(前五位:ATM、SMARCA4、BRCA2、MSH3、PARP4),8%存在胚系突变(前五位:ATM、BRCA2、PALB2、RAD50、BRCA1),为PARP抑制剂在中国人群的应用提供数据支撑,目前团队正开展CVL218(PARP抑制剂)在晚期实体瘤患者中的Ⅰb期研究,进一步探索疗效与安全性。
五、未来方向:多学科协作与联合治疗,持续拓展治疗边界
王理伟教授指出,晚期胰腺癌治疗已进入“精准分层、多靶点探索”的新时代,未来需重点关注三方面:1.生物标志物指导:加强基因检测普及(如NGS检测),明确KRAS亚型、DDR突变、Claudin18.2表达等,实现“量体裁衣”式治疗;2.联合治疗探索:如靶向药物联合化疗(HRS-4642+AG方案)、ADC联合靶向药物(SHR-A1921+HRS-4642)、免疫检查点抑制剂联合抗血管生成药物(TQB2450+安罗替尼),通过机制协同提升疗效;3.中国原研药物研发:加快本土创新药物(如KRAS G12D抑制剂、Claudin18.2 ADC)研发,积累更多中国人群数据,提升本土诊疗水平。当前,王理伟教授团队已启动多项临床研究(表2),涵盖PD-L1、RET、MTAP、CTLA-4/TIGIT等靶点,覆盖一线至后线治疗,未来将为晚期胰腺癌患者带来更多生存希望,推动“癌中之王”的诊疗困境逐步突破。

- 推荐文章
