- 首页 > 正文
岂有此“例”丨从脂肪肝到肝癌——一例MASH相关肝细胞癌的长期管理与成功移植
发表时间:2026-01-25 16:58:14
编者按
本期《岂有此“例”》聚焦一例发布于《新英格兰杂志》的代谢功能障碍相关脂肪性肝炎(MASH)肝硬化并发肝细胞癌病例。该病例清晰地展示了代谢性肝病“MASLD-MASH-肝纤维化-肝硬化-肝癌”的自然进程,强调了对于此类患者进行长期、规律监测的重要性。其诊疗过程凸显了多学科协作(MDT)在现代医学中的核心价值。尽管患者肝癌复发,但通过及时的局部消融治疗和最终的肝移植,实现了长期无病生存,体现了终末期肝病合并肝癌的综合治疗策略的成功。
此病例为临床医生提供了宝贵的借鉴:一是提高对代谢相关性脂肪性肝病这一“沉默杀手”潜在严重后果的认识;二是学习如何系统性地评估和管理此类患者,包括纤维化分期、肝癌筛查以及移植时机的把握;三是关注肝移植术后患者心脑血管等肝外代谢并发症的长期管理。本病例堪称代谢性肝病全程管理的典范,值得深入研读。
1.患者信息
患者,男性,59岁,有肥胖、血脂异常和高血压病史,因肝细胞癌在本院肿瘤科接受评估。
约12.5年前,该患者在另一家医院接受初级保健医生检查时,偶然发现其天冬氨酸氨基转移酶和丙氨酸氨基转移酶水平升高。电解质和促甲状腺激素水平正常,肾功能检测结果也无异常。由于患者自述无饮酒史,初步诊断为代谢功能障碍相关脂肪性肝病(MASLD,此前称为非酒精性脂肪性肝病)。
近3年,患者因乏力、疲劳和暗红色粪便在第二家医院接受评估。食管胃十二指肠镜检查显示符合胆汁反流性胃炎的改变;无静脉曲张或门静脉高压性胃病证据。结肠镜检查除横结肠有一小息肉(已切除)外无异常。诊断为幽门螺杆菌感染,开始使用抗生素和奥美拉唑治疗。天冬氨酸氨基转移酶和丙氨酸氨基转移酶水平持续升高,遂进行进一步检测。
乙型肝炎表面抗原和核心抗体检测结果为阴性,丙型肝炎病毒抗体检测亦为阴性。乙型肝炎表面抗体检测呈阳性,血液球蛋白水平正常。据报告,腹部超声检查显示肝脏大小正常但实质回声不均,肝内或肝外胆管无扩张,脾肿大(最大径为16.7 cm;参考值<13.2 cm),脾门血管明显提示静脉曲张。患者被转诊至胃肠病科门诊评估。
6个月后,患者在第三家医院的胃肠病科门诊接受评估。他再次否认饮酒史。唯一服用的药物是厄贝沙坦,无糖皮质激素治疗史。血压为152/82 mmHg。体重115 kg,身高175 cm,体重指数(体重公斤数除以身高米数的平方)为37.6。巩膜和皮肤无黄染。腹部肥胖,肝脏延伸至右上腹越过中线,脾脏未触及。胸部可见蜘蛛痣,其余检查正常。
2.初步诊断讨论
KathleenE.Corey医生分析,该男性患者47岁时,因肥胖、血脂异常和高血压但无饮酒史,在常规检测中发现天冬氨酸氨基转移酶和丙氨酸氨基转移酶水平升高,初步诊断为MASLD。3年多后,体检发现胸部蜘蛛痣和肝肿大,符合慢性肝病表现。6个月前,正常血白蛋白水平和国际标准化比值提示肝脏合成功能完整。患者出现血小板减少症,这可能与门静脉高压及相关脾肿大有关,源于血小板脾内滞留以及血小板生成素减少导致的血小板生成受损。影像学显示肝脏回声不均,提示脂肪肝浸润或慢性肝病,同时显示脾肿大和脾静脉曲张,符合门静脉高压表现,可能提示肝硬化。
该患者丙型肝炎病毒抗体检测为阴性。未服用任何与药物诱导MASLD相关的药物,如长期使用糖皮质激素、甲氨蝶呤、胺碘酮或他莫昔芬。他始终否认饮酒,排除ALD和metALD可能。
该患者有多个心脏代谢风险因素,符合MASLD及其进展形式——代谢功能障碍相关脂肪性肝炎(MASH,此前称为非酒精性脂肪性肝炎)的诊断标准。其风险因素包括肥胖、高血压和高甘油三酯血症。在无其他肝病病因且影像学显示肝脏脂肪浸润的情况下,这些心脏代谢风险因素证实该患者的MASLD诊断正确。若当时接诊该患者,会进一步检测MASLD相关共存疾病,包括空腹血脂panel评估血脂异常,以及测量血糖、糖化血红蛋白和胰岛素水平评估胰岛素抵抗。还需考虑遗传性疾病如低β脂蛋白血症(以低低密度脂蛋白胆固醇和载脂蛋白B水平为特征)和溶酶体酸性脂肪酶缺乏症。一旦确诊MASLD,下一步是评估患者肝纤维化程度。
Dudzinski医生补充,本例患者无法进行弹性成像和ELF检测,隧被转诊行肝活检。
MariMino-Kenudson医生介绍,转诊2个月后(即本次评估9年前),第三家医院的肝活检显示符合慢性脂肪性肝炎的特征(图1)。门静脉区显著炎症伴桥接纤维化(3期)。多个肝细胞胞质内见斑片状分布的大泡性脂肪变,符合轻度脂肪变性,部分肝细胞周围有淋巴细胞(淋巴细胞卫星现象)。部分肝细胞体积增大、胞质不规则透明,符合气球样变,部分气球样变肝细胞内见形成不良的Mallory-Denk小体(胞质内细胞骨架聚集物)。但未见ALD特征性的形成良好的嗜酸性绳状Mallory小体。这些特征组合符合脂肪性肝炎。尽管少数区域有中度炎症,但为混合炎症细胞浸润,无浆细胞突出。三色染色显示胶原纤维呈带状纤维化和进展的窦周纤维化分割肝小叶;未见提示已形成肝硬化的良好再生肝细胞结节。
Corey医生指出,肝活检见大泡性脂肪变、肝细胞气球样变和小叶炎症,证实MASH诊断。这些肝损伤特征区分了MASH与MASLD(后者无这些特征)。门静脉炎症也可出现于MASH,但非诊断必需。本例最重要的特征是进展性纤维化。3或4期纤维化的死亡或肝移植风险为1/3.97至1/11.97,需积极管理。
管理任何分期纤维化MASLD或MASH的基础是减重,因此建议该患者减肥。1年内减重至少10%可使90%的MASH患者病情缓解,45%的患者纤维化至少减轻一个分期。抗阻训练、有氧运动和地中海饮食可改善MASLD的影像学特征,推荐作为标准治疗。尽管该患者治疗时尚未上市,resmetirom(一种甲状腺激素受体β选择性激动剂)现已被批准用于治疗2或3期纤维化MASH。
肝细胞癌是MASH肝硬化的已知并发症,少数情况下也可发生于非肝硬化MASH。鉴于肝细胞癌风险,建议对MASH肝硬化患者进行筛查,通常每6个月进行一次影像学检查。该患者活检显示3期纤维化,但超声检查见静脉曲张和脾肿大提示很可能为MASH肝硬化。因此,对该患者进行肝细胞癌筛查是合适的。
3.制定治疗决策
Corey医生分析,患者因MASH肝硬化并发肝细胞癌转诊至本院。肝细胞癌治疗选项包括局部治疗(如消融、外照射放疗和经动脉栓塞)、手术切除和肝移植。无肝硬化或肝硬化无临床显著门静脉高压的患者可行手术切除。更晚期肝病患者(如本例MASH肝硬化)首选肝移植,因可同时治愈肝细胞癌和基础肝病。
本例肝硬化新诊断肝细胞癌符合米兰标准,肝移植为首选治疗。新英格兰地区等待已故供体肝通常超过1年。等待移植期间需监测MELD3.0评分和Surveillance影像学。
Guimaraes医生介绍,本院初诊1周后,行静脉增强肝脏MRI。T2加权成像显示肝7段一1.5×1.3 cm病变,动脉早期强化伴高信号。邻近无强化区可能反映酒精消融术后改变。肝实质表现符合肝硬化和脂肪肝浸润。见脾肿大、胃周和脾周侧支血管明显,门静脉和脾静脉通畅。分期评估胸部CT见非特异性结节,直径≤3 mm。3个月后,复查静脉增强肝脏MRI。T2加权成像显示肝7段病变增大至1.8×1.6 cm,持续动脉早期强化。
Corey医生指出,酒精消融术后病变缩小(直径2.8 cm至1.5 cm)提示初始治疗有效。但后续增大提示既往治疗部位肝细胞癌复发。等待肝移植期间需进一步治疗干预。
Guimaraes医生介绍,1个月后,CT引导下行经皮射频消融术。治疗后1个月MRI显示肝7段消融成功。但肝5段见一直径1.5 cm新病变,动脉早期强化伴快速洗脱,提示另一肝细胞癌病灶。
5周后,肝5段病变行射频消融术。治疗后1个月MRI显示肝5段和7段消融成功。3个月后复查MRI见消融区无变化,但出现一新发亚厘米病灶伴动脉早期强化。同期胸部CT显示肺结节无变化。
Dudzinski医生介绍,入院19个月后,患者成功接受已故供体肝移植。
4.病理讨论
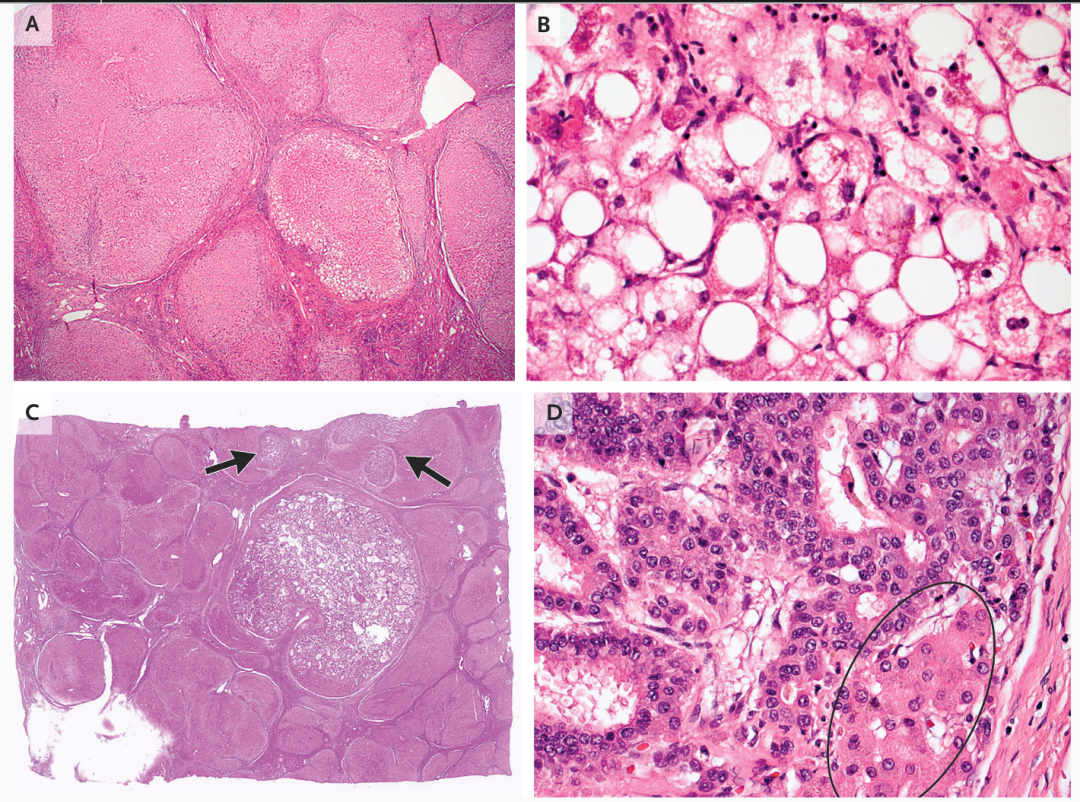
Mino-Kenudson医生介绍,移植肝病理检查(图2)显示背景实质主要为微结节性肝硬化。尽管大多数肝硬化结节无脂肪变,少数结节见脂肪变和以肝细胞气球样变为特征的脂肪性肝炎。移植肝右叶见三处病变。两处因射频消融完全坏死,第三处见存活肝细胞癌证据,主瘤和卫星结节呈腺泡状或小梁状生长模式(或二者兼具),肿瘤细胞核质比远高于正常肝细胞。一卫星结节部分围以肌壁,提示血管侵犯后肿瘤在门脉系统内膨胀性生长。这些表现符合脂肪性肝炎背景下微结节性肝硬化发生的肝细胞癌。基于血管侵犯,肿瘤确定为病理分期2期。
5.补充治疗与随访
Corey医生介绍,移植后14年,患者情况良好,无肝硬化或肝细胞癌复发的临床或影像学证据。
Dudzinski医生指出,MASLD和MASH是心血管疾病的独立风险因素,后者是这两种疾病患者的主要死因。因此医生需理解脂肪性肝病的多系统效应及其对初级保健的意义。肝移植后数年,该患者甘油三酯水平在300~400 mg/dL之间(参考值<250 mg/dL),第6年峰值达1080 mg/dL。甘油三酯水平升高部分认为与西罗莫司使用相关。免疫抑制治疗切换为他克莫司,停用氢氯噻嗪,开始他汀治疗。患者继续接受心脏和内分泌科护理以管理高血压、血脂异常和移植后糖尿病。
MASLD或MASH患者还可能存在心室壁增厚、舒张功能障碍和射血分数保留的心力衰竭。其他相关疾病包括瓣膜硬化、心肌能量代谢改变、房性和室性心律失常易感性增加、校正QT间期延长和传导缺陷。该患者进行性心动过缓和一度房室传导阻滞持续至移植后10年,届时新发房颤伴慢心室率。心律监测显示频发非持续性室性心动过速。因无法接受必要的速率控制药物,植入双腔起搏器。
参考文献:Corey KE, Dudzinski DM, Guimaraes AR, Mino-Kenudson M. Case 9-2025: A 59-Year-Old Man with Hepatocellular Carcinoma. N Engl J Med. 2025 Mar 27;392(12):1216-1227. doi: 10.1056/NEJMcpc1909622. PMID: 40138556.
本期《岂有此“例”》聚焦一例发布于《新英格兰杂志》的代谢功能障碍相关脂肪性肝炎(MASH)肝硬化并发肝细胞癌病例。该病例清晰地展示了代谢性肝病“MASLD-MASH-肝纤维化-肝硬化-肝癌”的自然进程,强调了对于此类患者进行长期、规律监测的重要性。其诊疗过程凸显了多学科协作(MDT)在现代医学中的核心价值。尽管患者肝癌复发,但通过及时的局部消融治疗和最终的肝移植,实现了长期无病生存,体现了终末期肝病合并肝癌的综合治疗策略的成功。
此病例为临床医生提供了宝贵的借鉴:一是提高对代谢相关性脂肪性肝病这一“沉默杀手”潜在严重后果的认识;二是学习如何系统性地评估和管理此类患者,包括纤维化分期、肝癌筛查以及移植时机的把握;三是关注肝移植术后患者心脑血管等肝外代谢并发症的长期管理。本病例堪称代谢性肝病全程管理的典范,值得深入研读。

1.患者信息
患者,男性,59岁,有肥胖、血脂异常和高血压病史,因肝细胞癌在本院肿瘤科接受评估。
约12.5年前,该患者在另一家医院接受初级保健医生检查时,偶然发现其天冬氨酸氨基转移酶和丙氨酸氨基转移酶水平升高。电解质和促甲状腺激素水平正常,肾功能检测结果也无异常。由于患者自述无饮酒史,初步诊断为代谢功能障碍相关脂肪性肝病(MASLD,此前称为非酒精性脂肪性肝病)。
近3年,患者因乏力、疲劳和暗红色粪便在第二家医院接受评估。食管胃十二指肠镜检查显示符合胆汁反流性胃炎的改变;无静脉曲张或门静脉高压性胃病证据。结肠镜检查除横结肠有一小息肉(已切除)外无异常。诊断为幽门螺杆菌感染,开始使用抗生素和奥美拉唑治疗。天冬氨酸氨基转移酶和丙氨酸氨基转移酶水平持续升高,遂进行进一步检测。
乙型肝炎表面抗原和核心抗体检测结果为阴性,丙型肝炎病毒抗体检测亦为阴性。乙型肝炎表面抗体检测呈阳性,血液球蛋白水平正常。据报告,腹部超声检查显示肝脏大小正常但实质回声不均,肝内或肝外胆管无扩张,脾肿大(最大径为16.7 cm;参考值<13.2 cm),脾门血管明显提示静脉曲张。患者被转诊至胃肠病科门诊评估。
6个月后,患者在第三家医院的胃肠病科门诊接受评估。他再次否认饮酒史。唯一服用的药物是厄贝沙坦,无糖皮质激素治疗史。血压为152/82 mmHg。体重115 kg,身高175 cm,体重指数(体重公斤数除以身高米数的平方)为37.6。巩膜和皮肤无黄染。腹部肥胖,肝脏延伸至右上腹越过中线,脾脏未触及。胸部可见蜘蛛痣,其余检查正常。
2.初步诊断讨论
KathleenE.Corey医生分析,该男性患者47岁时,因肥胖、血脂异常和高血压但无饮酒史,在常规检测中发现天冬氨酸氨基转移酶和丙氨酸氨基转移酶水平升高,初步诊断为MASLD。3年多后,体检发现胸部蜘蛛痣和肝肿大,符合慢性肝病表现。6个月前,正常血白蛋白水平和国际标准化比值提示肝脏合成功能完整。患者出现血小板减少症,这可能与门静脉高压及相关脾肿大有关,源于血小板脾内滞留以及血小板生成素减少导致的血小板生成受损。影像学显示肝脏回声不均,提示脂肪肝浸润或慢性肝病,同时显示脾肿大和脾静脉曲张,符合门静脉高压表现,可能提示肝硬化。
该患者丙型肝炎病毒抗体检测为阴性。未服用任何与药物诱导MASLD相关的药物,如长期使用糖皮质激素、甲氨蝶呤、胺碘酮或他莫昔芬。他始终否认饮酒,排除ALD和metALD可能。
该患者有多个心脏代谢风险因素,符合MASLD及其进展形式——代谢功能障碍相关脂肪性肝炎(MASH,此前称为非酒精性脂肪性肝炎)的诊断标准。其风险因素包括肥胖、高血压和高甘油三酯血症。在无其他肝病病因且影像学显示肝脏脂肪浸润的情况下,这些心脏代谢风险因素证实该患者的MASLD诊断正确。若当时接诊该患者,会进一步检测MASLD相关共存疾病,包括空腹血脂panel评估血脂异常,以及测量血糖、糖化血红蛋白和胰岛素水平评估胰岛素抵抗。还需考虑遗传性疾病如低β脂蛋白血症(以低低密度脂蛋白胆固醇和载脂蛋白B水平为特征)和溶酶体酸性脂肪酶缺乏症。一旦确诊MASLD,下一步是评估患者肝纤维化程度。
Dudzinski医生补充,本例患者无法进行弹性成像和ELF检测,隧被转诊行肝活检。
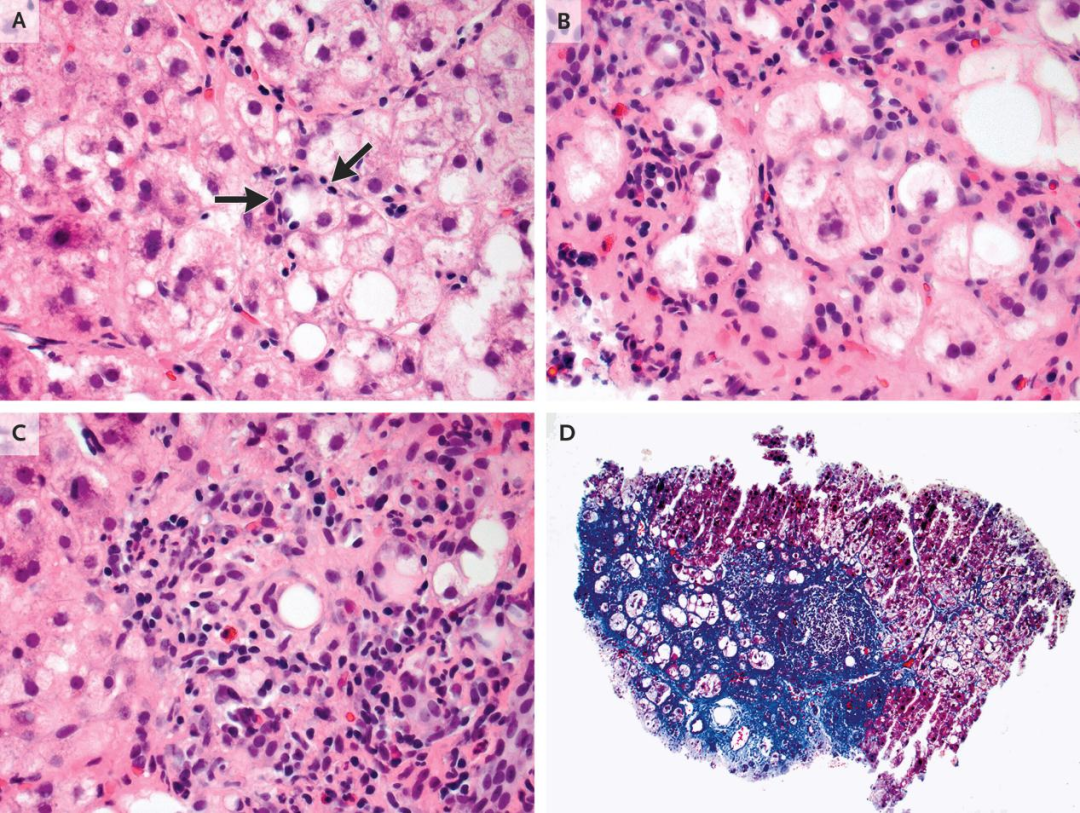
MariMino-Kenudson医生介绍,转诊2个月后(即本次评估9年前),第三家医院的肝活检显示符合慢性脂肪性肝炎的特征(图1)。门静脉区显著炎症伴桥接纤维化(3期)。多个肝细胞胞质内见斑片状分布的大泡性脂肪变,符合轻度脂肪变性,部分肝细胞周围有淋巴细胞(淋巴细胞卫星现象)。部分肝细胞体积增大、胞质不规则透明,符合气球样变,部分气球样变肝细胞内见形成不良的Mallory-Denk小体(胞质内细胞骨架聚集物)。但未见ALD特征性的形成良好的嗜酸性绳状Mallory小体。这些特征组合符合脂肪性肝炎。尽管少数区域有中度炎症,但为混合炎症细胞浸润,无浆细胞突出。三色染色显示胶原纤维呈带状纤维化和进展的窦周纤维化分割肝小叶;未见提示已形成肝硬化的良好再生肝细胞结节。
Corey医生指出,肝活检见大泡性脂肪变、肝细胞气球样变和小叶炎症,证实MASH诊断。这些肝损伤特征区分了MASH与MASLD(后者无这些特征)。门静脉炎症也可出现于MASH,但非诊断必需。本例最重要的特征是进展性纤维化。3或4期纤维化的死亡或肝移植风险为1/3.97至1/11.97,需积极管理。
管理任何分期纤维化MASLD或MASH的基础是减重,因此建议该患者减肥。1年内减重至少10%可使90%的MASH患者病情缓解,45%的患者纤维化至少减轻一个分期。抗阻训练、有氧运动和地中海饮食可改善MASLD的影像学特征,推荐作为标准治疗。尽管该患者治疗时尚未上市,resmetirom(一种甲状腺激素受体β选择性激动剂)现已被批准用于治疗2或3期纤维化MASH。
肝细胞癌是MASH肝硬化的已知并发症,少数情况下也可发生于非肝硬化MASH。鉴于肝细胞癌风险,建议对MASH肝硬化患者进行筛查,通常每6个月进行一次影像学检查。该患者活检显示3期纤维化,但超声检查见静脉曲张和脾肿大提示很可能为MASH肝硬化。因此,对该患者进行肝细胞癌筛查是合适的。
3.制定治疗决策
Corey医生分析,患者因MASH肝硬化并发肝细胞癌转诊至本院。肝细胞癌治疗选项包括局部治疗(如消融、外照射放疗和经动脉栓塞)、手术切除和肝移植。无肝硬化或肝硬化无临床显著门静脉高压的患者可行手术切除。更晚期肝病患者(如本例MASH肝硬化)首选肝移植,因可同时治愈肝细胞癌和基础肝病。
本例肝硬化新诊断肝细胞癌符合米兰标准,肝移植为首选治疗。新英格兰地区等待已故供体肝通常超过1年。等待移植期间需监测MELD3.0评分和Surveillance影像学。
Guimaraes医生介绍,本院初诊1周后,行静脉增强肝脏MRI。T2加权成像显示肝7段一1.5×1.3 cm病变,动脉早期强化伴高信号。邻近无强化区可能反映酒精消融术后改变。肝实质表现符合肝硬化和脂肪肝浸润。见脾肿大、胃周和脾周侧支血管明显,门静脉和脾静脉通畅。分期评估胸部CT见非特异性结节,直径≤3 mm。3个月后,复查静脉增强肝脏MRI。T2加权成像显示肝7段病变增大至1.8×1.6 cm,持续动脉早期强化。
Corey医生指出,酒精消融术后病变缩小(直径2.8 cm至1.5 cm)提示初始治疗有效。但后续增大提示既往治疗部位肝细胞癌复发。等待肝移植期间需进一步治疗干预。
Guimaraes医生介绍,1个月后,CT引导下行经皮射频消融术。治疗后1个月MRI显示肝7段消融成功。但肝5段见一直径1.5 cm新病变,动脉早期强化伴快速洗脱,提示另一肝细胞癌病灶。
5周后,肝5段病变行射频消融术。治疗后1个月MRI显示肝5段和7段消融成功。3个月后复查MRI见消融区无变化,但出现一新发亚厘米病灶伴动脉早期强化。同期胸部CT显示肺结节无变化。
Dudzinski医生介绍,入院19个月后,患者成功接受已故供体肝移植。
4.病理讨论
Mino-Kenudson医生介绍,移植肝病理检查(图2)显示背景实质主要为微结节性肝硬化。尽管大多数肝硬化结节无脂肪变,少数结节见脂肪变和以肝细胞气球样变为特征的脂肪性肝炎。移植肝右叶见三处病变。两处因射频消融完全坏死,第三处见存活肝细胞癌证据,主瘤和卫星结节呈腺泡状或小梁状生长模式(或二者兼具),肿瘤细胞核质比远高于正常肝细胞。一卫星结节部分围以肌壁,提示血管侵犯后肿瘤在门脉系统内膨胀性生长。这些表现符合脂肪性肝炎背景下微结节性肝硬化发生的肝细胞癌。基于血管侵犯,肿瘤确定为病理分期2期。
5.补充治疗与随访
Corey医生介绍,移植后14年,患者情况良好,无肝硬化或肝细胞癌复发的临床或影像学证据。
Dudzinski医生指出,MASLD和MASH是心血管疾病的独立风险因素,后者是这两种疾病患者的主要死因。因此医生需理解脂肪性肝病的多系统效应及其对初级保健的意义。肝移植后数年,该患者甘油三酯水平在300~400 mg/dL之间(参考值<250 mg/dL),第6年峰值达1080 mg/dL。甘油三酯水平升高部分认为与西罗莫司使用相关。免疫抑制治疗切换为他克莫司,停用氢氯噻嗪,开始他汀治疗。患者继续接受心脏和内分泌科护理以管理高血压、血脂异常和移植后糖尿病。
MASLD或MASH患者还可能存在心室壁增厚、舒张功能障碍和射血分数保留的心力衰竭。其他相关疾病包括瓣膜硬化、心肌能量代谢改变、房性和室性心律失常易感性增加、校正QT间期延长和传导缺陷。该患者进行性心动过缓和一度房室传导阻滞持续至移植后10年,届时新发房颤伴慢心室率。心律监测显示频发非持续性室性心动过速。因无法接受必要的速率控制药物,植入双腔起搏器。
参考文献:Corey KE, Dudzinski DM, Guimaraes AR, Mino-Kenudson M. Case 9-2025: A 59-Year-Old Man with Hepatocellular Carcinoma. N Engl J Med. 2025 Mar 27;392(12):1216-1227. doi: 10.1056/NEJMcpc1909622. PMID: 40138556.
- 推荐文章
高危胃肠道间质瘤(GIST)术后辅助治疗的五大争议与决策
胃食管交界部癌的多模式治疗:现状与未来方向丨2025韩国国际胃癌周
Jeeyun Lee教授解析多组学技术如何重塑胃癌免疫微环境丨2025韩国国际胃癌周
王绿化教授解析食管癌临床研究新进展:免疫治疗引领格局变革,中国原创方案重塑国际标准丨CSCO 2025
Nature Medicine丨AI赋能结直肠癌手术:个性化围手术期治疗的临床突破与未来方向
Joo Ha Hwang教授详解胃癌一、二级预防全球行动丨2025韩国国际胃癌周
食管鳞癌新辅助治疗迎来新突破!化免方案VS放化疗,生存、复发数据全面对比
李健教授:探索胃肠间质瘤联合治疗新策略,攻克TKIs耐药难关丨CACA东北整合肿瘤学大会 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025-09-30 19:15:32 河北 手机阅读
共探胃癌诊疗新路径!2025韩国国际胃癌周中韩专场顺利举办,四大前沿研究擘画治疗未来
CACA东北整合肿瘤学大会丨徐泽宽教授:精准治疗时代胃癌诊疗机遇和挑战并存
应杰儿教授:以“整合”破局胃癌诊疗难题,以“康复”守护患者长期预后丨2025CACA东北整合肿瘤学大会
王峰教授展望未来食管癌精准免疫治疗新策略丨CSCO名家演讲集
ESMO 2025丨LBA重磅发布,消化道肿瘤领域最新进展一文纵览!
王峰教授:食管癌免疫治疗2.0时代:新联合策略+耐药探索丨CSCO名家演讲集
CACA东北整合肿瘤学大会丨李茂全教授:建立“诊、治、康、护、养”完整诊疗体系,推动胰腺癌个体化和规范化诊疗 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025年9月25日 18:20
聚焦胃癌肝转移诊疗新进展:陈凛教授解析外科价值与多学科协作策略丨2025CACA东北整合肿瘤学大会
国际视角丨年轻人注意!早发性癌症发病率上升,肥胖和代谢差可能是“关键推手”
CSCO 2025丨吴胤瑛教授深度解读神经内分泌瘤诊疗指南更新,破局副神经节瘤精准诊疗新纪元
CSCO 2025丨方维佳教授详解肝癌围手术期免疫治疗新进展,这些突破值得关注!
CSCO 2025丨钱浩然主任医师解读高危GIST术后辅助治疗指南推荐与五大争议热点的破局之道
CSCO 2025丨王理伟教授解析晚期胰腺癌新药研究进展,精准治疗开启多靶点探索新时代
CSCO 2025丨邓艳红教授:结直肠癌中FOLFOXIRI三药方案临床应用进展
“瘤瘤”新知丨真实世界研究表明风险分层工具可提高上消化道肿瘤检出率
CSCO 2025丨项晓军教授:免疫治疗重塑胃癌“慢病化”全程管理新范式
岂有此“例”丨一例CLDN18.2阳性晚期胃癌患者接受含佐妥昔单抗治疗后出现胃炎的病例分析
CSCO名家视点丨李恩孝教授:胆道恶性肿瘤中国专家共识发布,加速我国胆道肿瘤诊疗规范化和精准化进程
CSCO 2025丨从“千人一方”到“量体裁衣",唐勇教授揭秘胃癌免疫治疗的精准标尺与分层策略
CSCO 2025丨勾红峰教授:免疫治疗时代下局部进展期胃癌诊治策略革新,豁免手术或成为可能
国际视角丨KRAS G12C突变结直肠癌最新进展:联合疗法开启治疗新纪元
术前贫血对直肠癌保肛手术近期及远期疗效有哪些影响?一项回顾性研究揭晓答案
革故鼎新,步召德教授详解直肠癌新辅助治疗的进展、挑战与未来变革|华夏结直肠病学论坛
利用真实世界数据提升临床试验结果普适性:一项前瞻性研究带来的洞见
杨林教授解读结直肠癌免疫治疗进展:精准分层与动态监测是未来方向|华夏结直肠病学论坛
沈琳教授团队:非V600E BRAF突变转移性结直肠癌的持续挑战与前沿治疗策略
华夏结直肠病学论坛丨孙立峰教授:聚焦结直肠癌腹膜转移个体化和精准化治疗策略
素食防癌再添实锤!最新研究表明吃素可降低癌症风险
“瘤瘤”新知丨AI导致内镜医师技能退化?《柳叶刀》研究揭示医疗AI的双刃剑效应
“冷肿瘤”破局之道:胡志前教授解读MSS型结直肠癌免疫治疗困境及探索|华夏结直肠病学论坛
岂有此“例”丨从脂肪肝到肝癌——一例MASH相关肝细胞癌的长期管理与成功移植
老年Ⅱ~Ⅲ期结直肠癌患者能否从奥沙利铂辅助化疗中获益?大型回顾性研究为您答疑解惑
血液or组织?转移性结直肠癌生物标志物检测最佳标本如何选择
谋“防”重“治”,毛友生教授详解中国食管癌防治优化之路与青年医师培养新策|2025CACA华中整合肿瘤学大会
心灵驿站丨生与死的奇妙共舞
肿瘤学年鉴:BFR14长期随访结果表明,13% GIST患者生存超过20年!
晚期HCC生存与生活质量兼得的治疗方案是什么?这项荟萃分析给出提示
多学科协同筑基石,创新实践领前沿——交大一附院李恩孝教授团队胃癌诊疗之路探微
令人鼓舞!PD-1联合基于短程放疗的TNT使pMMR局部晚期直肠癌CR率近翻倍
谋“效”思“变”,王峰教授阐述食管癌免疫治疗时代下的生存之变与未来之策|2025CACA华中整合肿瘤学大会
大数据揭示!男性肝硬化患者肝癌风险是女性的2倍
主席说丨西北地区胃癌诊疗经验与探索:从差异中寻共识,以协作促发展
樊嘉院士团队最新突破性研究成果见刊STTT:双免联合化疗或为晚期BTC一线治疗开辟新方向,有望改写临床实践指南
全程、精准、以人为本,陈小兵教授畅谈食管癌整合诊疗新范式|2025CACA华中整合肿瘤学大会
量体裁衣,居来提教授详解食管癌不同分期的MDT“排兵布阵”与功能保留之道|2025CACA华中整合肿瘤学大会
国际视角丨知名肿瘤专家为您解析2025年胆道癌治疗现状
“瘤瘤”新知丨多吃十字花科蔬菜可以降低结直肠癌的风险
