- 首页 > 正文
警惕!大规模研究揭秘慢性HCV感染与PDAC诊断风险增加1.8倍相关,基因1、3型成“高危信号”
发表时间:2026-02-12 19:11:02
导读:
胰腺导管腺癌(PDAC)是恶性程度最高的消化道肿瘤之一,因早期诊断困难、易转移和耐药性强,素有“癌王”之称。目前已知的遗传因素仅能解释约10%的病例,识别可改变的风险因素已成为预防PDAC和改善患者预后的关键。
近年研究提示,丙型肝炎病毒(HCV)可能是PDAC的潜在风险因素之一。研究人员发现,在胰腺腺泡细胞中可检测到HCV抗原,且随着HCV相关肝病的恶化,胰腺酶水平会升高,这提示HCV与胰腺炎症之间存在联系,而胰腺炎症是PDAC进展的已知风险因素。然而,既往关于慢性未治疗HCV感染与PDAC关联的研究结论不一,且HCV不同基因型对PDAC风险的影响尚属未知。
在此背景下,研究人员依托美国退伍军人健康管理局(VA)系统开展了一项大规模回顾性队列研究。VA系统因HCV患病率高、筛查体系完善、电子健康记录完整,为精准分析提供了理想平台。研究结果显示,慢性HCV感染与PDAC诊断风险增加1.8倍显著相关,且HCV基因3型和1型导致的PDAC风险高于基因2型。这一发现为PDAC的预防和风险分层提供了新的方向。
研究方法
本研究为一项基于VA全国性数据的回顾性队列研究,旨在探讨HCV与PDAC风险之间的关联。研究对象为VA系统中年龄≥20岁、2001年10月1日至2020年9月30日期间在VA或VA关联医疗保险系统中留存HCV检测记录且至少有过一次住院或门诊就诊经历的退伍军人。为模拟长期风险并确保患者处于常规医疗随访中,研究者随机选取了首次就诊后至少1.5年的一次特定门诊就诊作为“索引日期”,该日期所在年份需有常规实验室检测记录。通过严格的排除标准(如基线时已患胰腺癌或转移性肿瘤),最终队列由所有接受过HCV检测的患者构成。
研究关注的暴露为HCV感染状态,包括慢性HCV感染、仅HCV暴露(无活动性感染证据)以及未感染HCV。主要关注的结局是至首次确诊PDAC的时间,其定义为在VA或关联的Medicare数据中出现至少1次住院或2次门诊的PDAC诊断代码。
数据分析时间为2023年10月至2025年9月。研究采用单变量与多变量Cox比例风险回归模型来评估慢性HCV状态与PDAC发病风险之间的关联,并对一系列人口统计学(年龄、性别、种族/民族)和临床协变量(体重指数、吸烟状况、酒精使用障碍、胰腺疾病、查尔森合并症指数及其特定组分等)进行了调整。分析中还考察了HCV状态与关键因素(如年龄、吸烟)的交互作用。此外,研究还进行了包括评估HCV基因型特异性风险在内的亚组分析,以及多项敏感性分析(如排除干扰素治疗者、排除基线癌症患者等),以检验主要结果的稳健性并处理潜在偏倚。统计分析使用Stata 18软件,设定双侧P<0.10为具有统计学显著性。
研究结果
在6 330 856例接受HCV检测的患者中(表1),中位年龄为61.6岁,其中男性占92.3%。按HCV状态划分:慢性HCV感染者占3.9%,仅HCV暴露者占3.3%,未感染HCV者占92.8%。完整病例分析共纳入5 628 360例患者,中位随访时间为5.1年。总体PDAC发生率为0.5%,确诊PDAC的中位时间为3.9年。在不同HCV暴露状态的PDAC患者中,中位生存时间相近(慢性HCV感染组:0.29年;HCV暴露组:0.31年;未感染HCV组:0.32年)。经年龄标准化的PDAC发病率显示:未感染HCV组为51.92例/10万人/年,HCV暴露组为67.97例/10万人/年,慢性HCV感染组则高达107.69例/10万人/年。按组别分析PDAC病例数:慢性HCV感染组1 520例(0.62%),HCV暴露组1 347例(0.64%),未感染HCV组30 148例(0.51%)。值得注意的是,慢性HCV感染组的中位年龄较轻,且黑人比例更高,吸烟、饮酒及肝病发生率也显著高于暴露组和未感染组。
表1. 接受HCV检测的退伍军人的基线特征
PDAC发病率
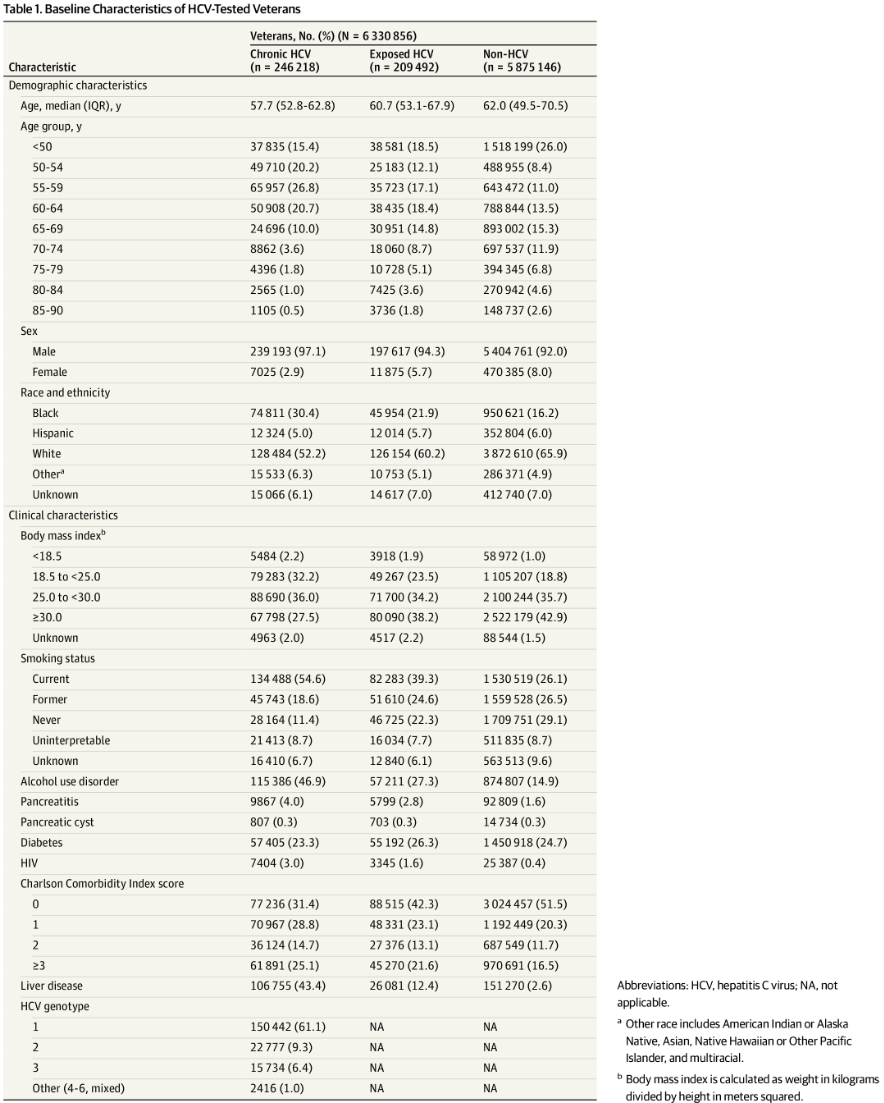
与HCV暴露组(中位年龄:68.5岁)和未感染HCV组(中位年龄:72.4岁)相比,慢性HCV感染组确诊PDAC的年龄更早(中位年龄:65.0岁)。PDAC病例占比在慢性HCV感染组中最高,HCV暴露组次之,未感染HCV组最低(图1)。
发病率分析显示,慢性HCV感染组的PDAC发病率为143.3/10万人/年,而未感染HCV组为80.6/10万人/年(图2)。
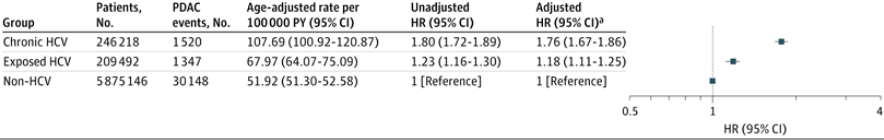
年龄分层分析表明,PDAC发病率随年龄增长而上升,直至80岁达到峰值(表2)。在30~80岁年龄段内,慢性HCV感染组的PDAC发病率始终高于未感染HCV组。但年龄与HCV状态之间未观察到具有临床意义的相乘交互作用。
表2. 慢性HCV与非HCV队列中每十岁年龄分层的PDAC发病率
慢性HCV感染与PDAC风险
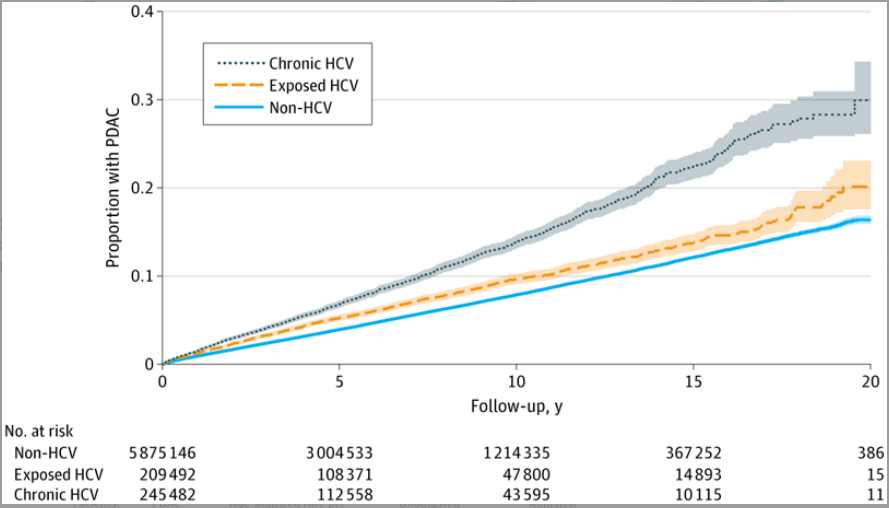
与未感染HCV组相比,HCV暴露组(未调整HR=1.23)以及慢性HCV感染组(未调整HR=1.80)发生PDAC的风险均更高(图2)。在校正协变量后,这种关联性依然持续存在(HCV暴露组调整后HR[aHR]=1.18;慢性HCV组aHR=1.76)(图2)。
根据影响程度从大到小排列,与PDAC发病显著相关的协变量包括:年龄、胰腺囊肿、胰腺炎、男性、当前吸烟、查尔森合并症指数评分、糖尿病、体重指数低于18.5、HIV感染、肝病、酒精使用障碍以及既往吸烟史。研究未发现吸烟、酒精使用障碍和胰腺炎存在显著的交互作用。
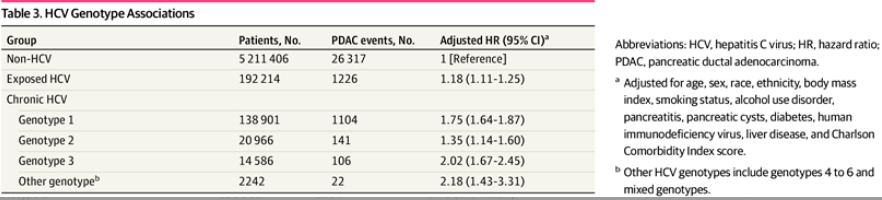
HCV基因型与PDAC风险
在慢性HCV感染组中,超过四分之三的患者(77.7%)拥有基因型数据。其中,基因1型患者占61.1%,基因2型占9.3%,基因3型占6.4%。
所有HCV基因型均与PDAC风险升高相关,按风险从高到低排序依次为:其他或混合基因型(aHR=2.18);基因3型(aHR=2.02);基因1型(aHR=1.75);基因2型(aHR=1.35)(表3)。
表3.HCV基因型关联分析
敏感性分析
总体而言,共有16.1%慢性HCV感染者接受了基于干扰素的治疗。此外,在整个队列中,有1.2%的HCV抗体阳性患者未报告HCV RNA检测结果。为验证研究结果的稳健性,研究人员进行了多项敏感性分析:首先,在排除上述人群后,所进行的两次分析均显示结果与主要分析一致。随后开展的进一步分析,包括排除基线时患有任何癌症的患者,以及仅纳入截至索引日期接受过HCV检测的患者,其结果均与主要分析相似。
研究结论
在本项队列研究中,研究发现慢性HCV感染与PDAC的发病风险增加相关。在HCV感染者中,基因1型(最为常见的基因型)和基因3型罹患PDAC的风险更高。未来的研究工作应聚焦于直接抗病毒药物(DAA)治疗HCV对于降低PDAC风险的影响,并深入探究与慢性HCV感染相关的PDAC致癌机制。
讨论
基于对超过600万退伍军人的大规模队列分析,本研究发现慢性HCV感染与PDAC风险增加存在独立关联,且在调整多种已知风险因素后该关联依然显著。研究进一步揭示,在HCV感染者中,基因1型和3型携带者的PDAC风险高于基因2型,且慢性感染者确诊PDAC的年龄更早。这些发现提示,慢性HCV感染本身是PDAC的一个可干预的风险因素。鉴于DAA对HCV的高治愈率,广泛推行HCV治疗不仅旨在消除病毒,更可能为降低PDAC风险带来额外获益,这为全球范围内的HCV防治倡议提供了新的有力依据。
参考文献
Levinson RN, et al. JAMA Netw Open. 2025 Nov 3;8(11):e2543701.
- 推荐文章
警惕!大规模研究揭秘慢性HCV感染与PDAC诊断风险增加1.8倍相关,基因1、3型成“高危信号”
及时戒烟,为时未晚!研究显示癌症确诊后及时戒烟可大幅降低死亡风险,改善治疗结局
CR率翻倍至45.5%!金晶教授领衔STELLAR Ⅱ研究突破pMMR/MSS型直肠癌治疗瓶颈
JAMA Surg:腹腔镜 vs. 开放远端胃癌根治术治疗T4a期胃癌的短期结局相当
超三分之一结直肠癌幸存者在确诊后5年内仍受肠道症状困扰,膳食纤维或成改善“良方”
Hepatology丨滕皋军院士领衔,19家三甲医院联合突破:精准筛选肝癌TACE-ICI-MTT治疗优势人群
2025 CCHIO大会CACA-Cancer Discovery专场圆满召开
CCHIO 2025丨王贵玉教授:2025版CACA结直肠癌诊疗指南三大核心更新深度解读
岂有此“例”丨胰十二指肠切除术后机器人辅助肝切除术安全实践——三例超晚期肝转移瘤微创治疗经验与筛选策略
ESMO Asia 2025丨胃肠肿瘤口头报告摘要揭晓,中国学者领衔8项突破性成果领跑亚洲
CCHIO 2025丨刘秀峰教授:双免 vs. 靶免一线之争,答案藏在细分与协同里
CCHIO 2025丨邓艳红教授:从技术切除到生物学治愈,结直肠癌转化治疗的优化与探索
重磅前瞻|2026 ASCO GI研讨会主旨演讲:Rathmell博士解码医患协作核心力量
2025 CCHIO丨陈凛教授:CACA胃癌诊疗指南再更新,推动我国规范化、精准化诊疗基层落地
CCHIO 2025丨陈小兵教授:“以人为本、赢在整合”——开启胆道胰腺肿瘤精准治疗新征程
CCHIO 2025丨袁瑛教授:RAS靶向治疗破局前行,双抗与ADC开启肠癌治疗新篇
凝聚协作共识,共绘全球癌症防治蓝图——2025 CCHIO国际研讨会Ⅰ圆满召开
国际视野丨一表带您看懂肝癌局部治疗如何抉择?
“把握当下:癌症研究塑造患者照护的未来”——2026 ASCO GI热点抢先知!
周总光教授揭秘结直肠癌转移基因组全新进化模式如何重塑外科临床决策丨第十届国家癌症中心结直肠癌学术会议
对话梅奥诊所专家:AI在肿瘤诊疗中的临床应用与未来挑战丨国家癌症中心结直肠癌学术会议 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025年11月7日 18:06 听全文
顾晋教授:AI浪潮下,外科医生的坚守与革新丨第十届国家癌症中心结直肠癌学术会议
蔡三军教授:解码大肠癌MDT核心精髓,展望3.0智能融合新图景丨第十届国家癌症中心结直肠癌学术会议
岂有此“例”丨反常规病例!一例MSI-H转移性结肠癌患者免疫治疗失败的病例报告
国际视角丨寡转移性食管胃癌治疗现状与最新研究进展
王锡山教授:顺应时代发展潮流,深入推广NOSES技术,实现患者“微创”目标
刘骞教授:以精细技术筑规范之基,以精准诊疗谋预后之优丨国家癌症中心结直肠癌学术会议
Ⅲ期临床研究证实术后保持良好运动习惯显著改善患者生存
许剑民教授:REAL研究首次证实机器人手术在中低位直肠癌中具有减少局部复发和保护器官功能的双重优势
ESMO 2025前沿丨胰腺癌研究日益聚焦ADC药物与溶瘤病毒
ESMO LBA专访|遗憾!IMbrave152研究未达主要终点,TIGIT抗体未能给晚期肝癌的一线治疗增效
ESMO 2025前沿丨三项口头报告证实新免疫联合策略将突破肝癌治疗局限
京华秋韵 术启未来丨第十届国家癌症中心结直肠癌学术会议在京隆重召开!
ESMO CHINA FOCUS中国视角论坛丨消化肿瘤专场:替雷利珠单抗引领治疗革新,精准策略点亮临床未来
ESMO 2025前沿丨晚期神经内分泌肿瘤新型放射治疗疗效值得期待
ESMO 2025丨FORTITUDE-101研究初步OS结果公布,可能不具备临床意义
岂有此“例”丨全球首例胃型十二指肠癌+胃癌碰撞瘤,术前诊断难点全解析
ESMO 2025丨重磅!三大新策略破解免疫治疗耐药困局,多线治疗失败患者迎曙光!
ESMO 2025丨KRAS G12D/V靶向治疗全面破局,四大研究改写实体瘤治疗格局
ESMO 2025国际视野丨ESMO特别贡献奖获得者Thierry Conroy教授追溯消化道肿瘤治疗变革
ESMO 2025前沿丨“冰火两重天”——HER2靶向治疗GC/GEJC令人惊喜,免疫联合折戟成沙
ESMO 2025 AI热潮来袭:大会主席专访定调转型方向,结直肠癌研究彰显临床价值
2025 ESMO速递丨胰腺癌新药研究取得突破,生物标志物指导PDAC个性化治疗
ESMO 2025丨重磅!KRAS G12C抑制剂多点突破,耐药与难治性实体瘤患者迎来新曙光
2025 ESMO速递:“靶免联合”拓展胃癌精准治疗新视野
高危胃肠道间质瘤(GIST)术后辅助治疗的五大争议与决策
胃食管交界部癌的多模式治疗:现状与未来方向丨2025韩国国际胃癌周
Jeeyun Lee教授解析多组学技术如何重塑胃癌免疫微环境丨2025韩国国际胃癌周
王绿化教授解析食管癌临床研究新进展:免疫治疗引领格局变革,中国原创方案重塑国际标准丨CSCO 2025
Nature Medicine丨AI赋能结直肠癌手术:个性化围手术期治疗的临床突破与未来方向
Joo Ha Hwang教授详解胃癌一、二级预防全球行动丨2025韩国国际胃癌周
食管鳞癌新辅助治疗迎来新突破!化免方案VS放化疗,生存、复发数据全面对比
李健教授:探索胃肠间质瘤联合治疗新策略,攻克TKIs耐药难关丨CACA东北整合肿瘤学大会 原创 肿瘤瞭望消化时讯 肿瘤瞭望消化时讯 2025-09-30 19:15:32 河北 手机阅读
共探胃癌诊疗新路径!2025韩国国际胃癌周中韩专场顺利举办,四大前沿研究擘画治疗未来
CACA东北整合肿瘤学大会丨徐泽宽教授:精准治疗时代胃癌诊疗机遇和挑战并存
